导言:研究发现,补充NAD+联合PD-L1抗体为免疫疗法耐药性肿瘤提供了一种新的治疗策略。
所有细胞都需要烟酰胺腺嘌呤二核苷酸(NAD+,一种生物能量分子),以执行基本功能和生存。但NAD+的产生(生物合成)在人类癌症中经常升高,在肿瘤的发生、进展和复发中起着关键作用。然而,NAD+代谢—制造、处理和使用NAD+的化学反应—如何通过逃避身体免疫反应来调节肿瘤进展,在很大程度上仍然未知。
来自中国二军医大的Wang等人在《细胞代谢》(Cell Metab)杂志上发表了一项研究,他们为细胞中NAD+合成促进肿瘤进展的细胞机制提供了证据。他们的实验表明,补充NAD+前体烟酰胺单核苷酸(NMN)提高了NAD+水平,并提高了对免疫疗法(一种有助于免疫系统抵御肿瘤的癌症治疗)有耐药性的肿瘤的治疗选择的有效性。
在他们的研究中,研究人员提供了来自小鼠身上的实验证据,证明NAD+生物合成途径中一种关键酶NAMPT的水平降低,导致攻击肿瘤的白细胞CD8+T细胞的激活增强。这些T细胞的激活促进了它们对抗肿瘤的功能。NAMPT酶水平的降低伴随着NAD+细胞水平的降低,表明NAD+代谢控制CD8+T细胞对抗肿瘤的功能。
他们的数据还表明,NAD+代谢可以通过提高癌症细胞上一种叫做PD-L1的蛋白质的水平来驱动肿瘤逃避免疫系统。癌症细胞表面PD-L1的存在通过与T细胞表面PD-1的受体结合来抑制T细胞的功能。癌症细胞的PD-L1和T细胞的PD-1之间的相互作用导致T细胞衰竭,即T细胞因结合过多来自肿瘤的外来颗粒而失去杀死癌细胞的能力,癌细胞逃避免疫反应。研究小组随后发现,肿瘤细胞中更多的NAMPT与癌细胞表面发现的PD-L1蛋白水平较高以及肿瘤逃避免疫反应的发生率较高相关。
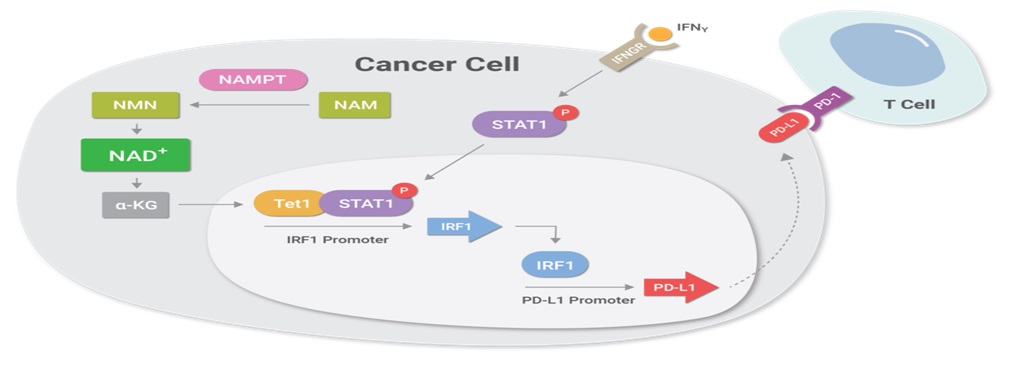
图1. NAD+代谢控制肿瘤细胞逃避免疫应答。更高水平的NAMPT酶促进NAD+生物合成,从而触发称为NAMPT-TET1-p--STAT1-IRF1-PD-L1轴的细胞级联反应,促进癌症细胞表面较高水平的PD-L1蛋白。从本质上讲,细胞级联促进了一种名为IRF1的蛋白质与编码PD-L1的DNA区域的结合,从而在肿瘤细胞表面诱导更高水平的PD-L1蛋白质水平。PD-L1与T细胞上的PD-1受体结合,导致T细胞衰竭,T细胞功能丧失,随后肿瘤细胞逃避免疫反应。
此外,研究人员的研究结果表明,补充NMN补充细胞NAD+水平可以增强旨在抑制PD-L1功能的免疫系统增强疗法的效果。这是因为较高的NAMPT表达水平可以预测这些疗法的更好疗效,很可能是由于NAMPT在细胞中NAD+合成中的作用,从而促进PD-L1在肿瘤细胞表面的呈递。当该小组在培养皿中用NMN补充小鼠的癌细胞时,他们发现这种补充NAD+的方法使肿瘤对免疫疗法敏感。科学家们用免疫系统中被称为PD-L1抗体的蛋白质组分治疗了补充NMN的肿瘤,作为一种抗癌疗法,可以显著抑制肿瘤的进展。
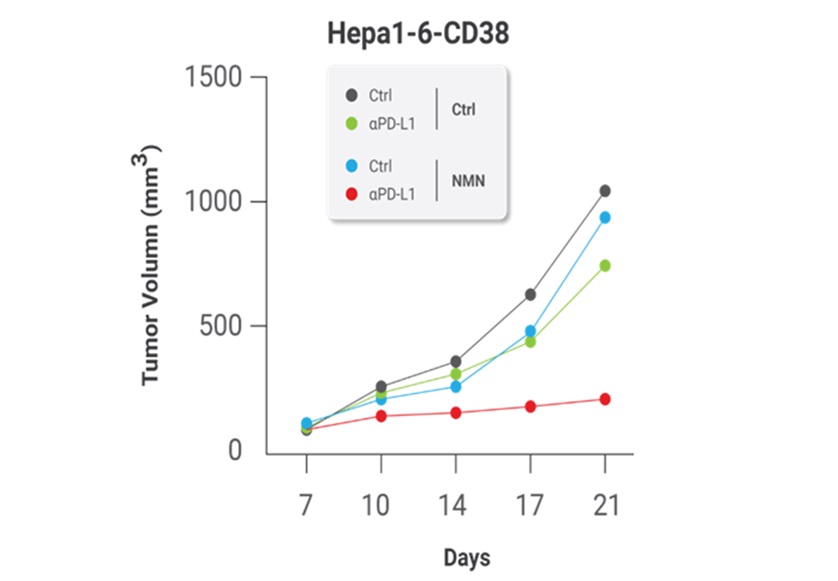
图2. NMN治疗增强了免疫疗法对抗癌症的效果。NMN治疗显著增强了PD-L1抗体、免疫系统蛋白质成分的抗癌作用。
这项研究阐明了NAD+代谢在调节肿瘤免疫逃避中的作用,NAD+水平的升高促进了PD-L1蛋白在肿瘤细胞上的呈递和随后的免疫细胞耗竭。此外,研究结果表明,用其前体NMN提高NAD+水平可以增强肿瘤对癌症免疫疗法的敏感性。
Wang及其同事在报告中表示:“NAD+补充剂与PD-L1抗体相结合,为免疫疗法耐药性肿瘤提供了一种新的治疗策略。”。
尽管如此,他们还是在动物肿瘤细胞中进行了这项研究,这只能部分概括人类肿瘤的病理生理学。补充NAD+和PD-L1是否能作为一种治疗策略,还需要在人体临床试验中进行验证。
来源:本网编辑 2024.04.20.
参考文献:
Lv H et al. NAD+ Metabolism Maintains Inducible PD-L1 Expression to Drive Tumor Immune Evasion. Cell Metab. 2021 Jan 5;33(1):110-127.e5.
其他参考文献:
Yu YR et al. Disturbed mitochondrial dynamics in CD8+ TILs reinforce T cell exhaustion. Nat Immunol. 2020 Dec;21(12):1540-1551.