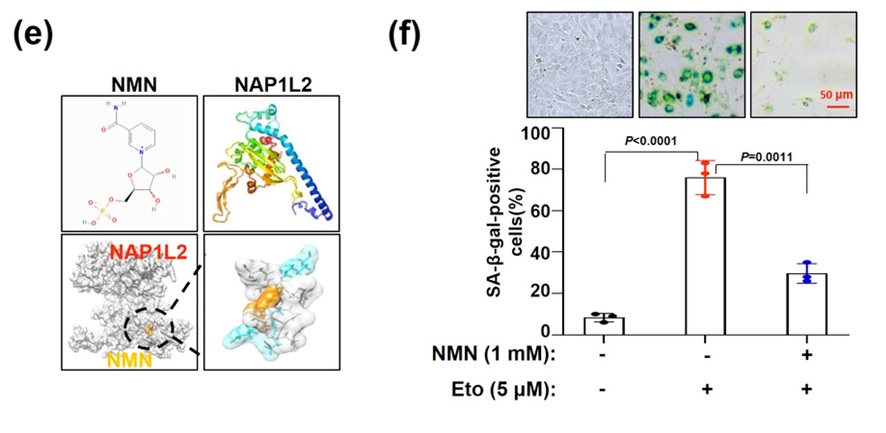
导言:美国知名机构联合研究表明,补充NMN可以保持端粒长度以对抗肝纤维化。染色体末端(端粒)保护帽的功能紊乱与NAD+的急剧下降有关。NMN增加NAD+水平可稳定端粒并改善肝纤维化。
染色体末端(端粒,Telomeres)的DNA随着年龄的增长而缩短,这与许多疾病有关,包括过早衰老。但这种情况究竟是如何发生并导致与年龄相关的疾病表现出来的,仍不确定。
来自美国Baylor医学院、MD Anderson癌症中心和宾州大学等多个机构的科学家对小鼠进行了实验,结果表明,补充烟酰胺单核苷酸(NMN)可以改善与DNA完整性降低相关的细胞状况,并对抗肝病。
论文作者Amano及其同事总结道:“我们的研究表明,NMN在持续的DNA损伤条件下以部分Sirt1依赖的方式稳定端粒,并抑制DNA损伤反应。”。
端粒与肝病
端粒受损的一个公认后果是组织瘢痕形成(纤维化)的风险增加,其中肝脏和肺部最常见。肝脏疾病被认为在端粒疾病(如再生障碍性贫血和骨髓衰竭)患者中发生的频率更高。端粒缩短也是由于后天原因(如乙型肝炎/丙型肝炎病毒感染或饮酒)导致的长期肝病的标志。端粒极短的肝细胞的积累与导致肝硬化、肝衰竭和癌症风险升高的疾病进展有关。
NAD+水平与端粒长度和疾病有何联系?
Sirtuins是一类NAD(+)依赖性酶,影响包括DNA修复在内的不同细胞过程。Sirtuins与衰老、代谢和年龄相关疾病密切相关。
在肝脏中,一种名为Sirt1的特定Sirtuins在7种Sirtuin中得到了特别好的研究,并已被证明在多种代谢过程中发挥重要作用,并与肝病的发展有关。
增加Sirt1的活性可以预防脂肪肝疾病并改善高脂肪饮食诱导的胰岛素抵抗,而肝脏中缺乏Sirt1会加速肝脏脂肪变性和胰岛素抵抗,并与炎症和氧化应激有关。
端粒功能障碍导致Sirtuin抑制
由于端粒功能障碍和Sirtuin抑制独立地与疾病易感性、加速衰老和寿命缩短高度相关,Amano等人研究了端粒长度、Sirtuin和肝病之间的相互作用。为了做到这一点,他们培育了具有非功能性端粒酶的小鼠,端粒酶是通过细胞分裂维持端粒的关键酶。
这些小鼠出现了过早衰老,端粒逐渐变短,尤其是在连续几代中。这些小鼠表现出端粒功能障碍的特征,如干细胞受损、细胞周转率高的组织再生缺陷、组织弱化(萎缩)、心肌疾病(心肌病)和寿命缩短。
与非转基因小鼠相比,端粒功能障碍小鼠肝脏中的Sirtuin水平降低。Sirtuin水平被抑制的程度似乎取决于端粒功能障碍的程度。除了蛋白质水平下降外,Sirtuin的活性也下降了。
NMN依赖性纤维变性挽救和端粒维持
Sirtuins对端粒功能障碍的抑制表明,基于NAD+前体对代谢紊乱、年龄相关疾病和干细胞衰竭的保护作用,提高几种Sirtuins的活性将是有利的。因此,Amano及其同事测试了NMN是否可以改善缺乏端粒酶的肝纤维化小鼠。在给肝脏注射疤痕剂之前,研究人员用NMN治疗小鼠两周。
他们发现,与非转基因小鼠相比,端粒功能障碍小鼠的NAD+水平下降更多,但NMN治疗可以缓解这种情况。有趣的是,即使在端粒酶缺乏的小鼠中,NMN治疗也能改善端粒的长度。
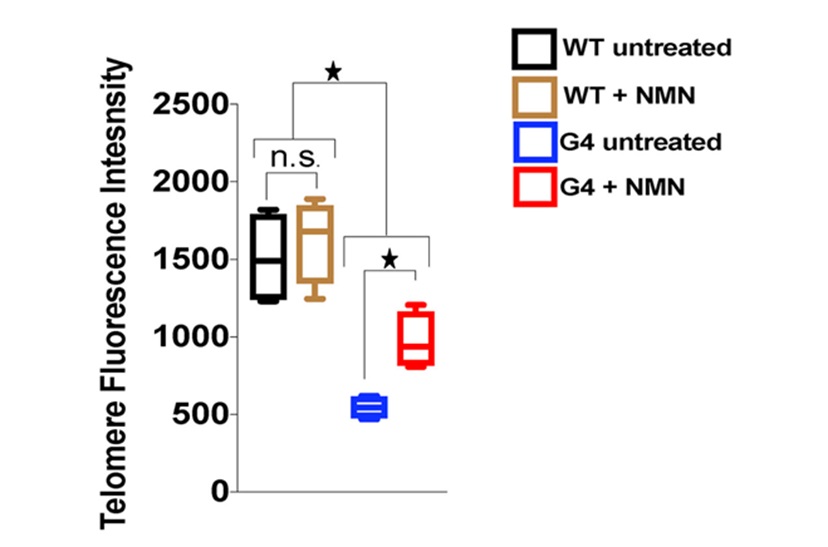
图示. NMN治疗与更长的端粒和减少的DNA损伤反应有关。在缺乏端粒酶的小鼠(G4未经治疗)中,端粒长度下降了三倍。NMN治疗这些小鼠(G4+NMN)显著恢复端粒长度,尽管其水平低于具有端粒酶的小鼠。
此外,NMN减少了端粒功能障碍小鼠和无端粒功能障碍小鼠的肝细胞损伤和纤维化。这表明NMN补充在DNA损伤增加的条件下保护细胞,而与端粒状态无关。
为了进一步探究观察到的NAD+对端粒长度和改善纤维化的影响需要哪种Sirtuins,Amano及其同事基于其在端粒维持中的作用以及其表达减少与肝脏病理有关,将重点放在了Sirt1上。为了测试NMN诱导的肝纤维化改善是否需要Sirt1,研究人员在未修饰的小鼠或缺乏端粒酶的小鼠中诱导Sirt1或缺乏Sirt1的小鼠纤维化。
他们发现NMN对肝纤维化的有益作用在很大程度上取决于Sirt1。为了确定NMN对小鼠端粒长度的影响是否依赖于Sirt1,Amano等人分析了这些小鼠的端粒长度和端粒完整性。与具有完整Sirt1的小鼠相比,NMN处理的缺乏Sirt1和端粒酶的小鼠具有更短的端粒和较差的端粒完整性。这表明Sirt1对NMN依赖性端粒维持和完整性有部分要求。
Amano及其同事总结道:“我们的研究表明,在DNA损伤的条件下,端粒功能失调的细胞中NAD+水平显著下降,而NAD+水平的升高以部分Sirt1依赖的方式维持端粒长度,这可以改善端粒依赖性肝病。”。
来源:本网编辑 2024.04.19.
主要参考文献:
Hisayuki Amano H et al. Telomere dysfunction induces sirtuin repression that drives telomere-dependent disease. Cell Metab, 2019 Jun 4;29(6):1274-1290.e9.
其他参考文献:
1. Chin L et al. p53 deficiency rescues the adverse effects of telomere loss and cooperates with telomere dysfunction to accelerate carcinogenesis. Cell. 1999 May 14;97(4):527-38
2. Sahin E et al. Telomere dysfunction induces metabolic and mitochondrial compromise. Nature, 2011 Feb 17;470(7334):359-65.