导言:研究表明,NMN与SIRT1蛋白结合激活骨再生(成骨)基因。通过刺激成骨,NMN可以防止骨质疏松症进展。
随着年龄的增长,新骨细胞的分解和生成(成骨)会下降。骨再生的混乱源于原始年轻状态(干性)耗尽的干细胞。骨干细胞的干性下降是由于干细胞在细胞周期中作为成骨细胞成熟时突变的积累。
换言之,随着干细胞成为成骨细胞,骨骼变硬,可能容易骨折,并形成毛孔(骨质疏松症),导致身体虚弱。临床医生可以使用虚弱指数来衡量虚弱程度,该指数代表老年人的整体健康状况。出于这些原因,研究一直致力于寻找保持骨间充质干细胞(BMSCs)干性的方法,BMSCs是一种产生成骨细胞并同时产生骨组织的干细胞。
NMN基因修复老年人骨干细胞
先前的研究表明,烟酰胺腺嘌呤二核苷酸(NAD+)的直接前体烟酰胺单核苷酸(NMN)可以恢复小鼠和大鼠等啮齿动物的骨组织健康。虽然如此,天津医科大学的Liu和同事利用年轻和老年患者的骨髓基质干细胞来测试NMN是否能恢复这些细胞中的表观遗传密码,即年轻的基因表达模式。在此过程中,天津的研究团队发现,接受化疗和氧化应激的骨髓基质干细胞在接受NMN治疗后表现出更强的干性。有趣的是,该研究团队报告了进一步的数据,表明NMN与DNA结合,有可能使基因表达谱恢复活力。
核小体组装蛋白1样2(NAP1L2)表达增加与衰老相关。LIu及其同事假设,随着NAP1L2水平的升高,这种蛋白质,一种核小体伴侣,会从DNA包裹的蛋白质(核小体)中去除被称为乙酰基的分子标签。NAP1L2还募集去乙酰化酶蛋白Sirtuin1(SIRT1),该蛋白从驱动成骨的基因的启动子区域去除乙酰基。
NAP1L2蛋白水平随年龄增长而增加,与虚弱相关
为了验证这一观点,天津的研究小组试图将NAP1L2蛋白表达的增加与老年人骨髓基质干细胞的衰老联系起来。为了测量衰老,研究人员用分子标记物β-半乳糖苷酶测量衰老。他们还发现了染色体末端(端粒)的功能障碍。此外,他们对老年BMSC蛋白水平的分析揭示了过氧化氢(H2O2)胁迫BMSC后,衰老相关分泌表型(SASP)标记物,同时NAP1L2水平增加。这些结果表明,BMSC衰老和干性丧失与NAP1L2水平升高同时发生。
NMN与NAP1L2结合刺激细胞再生SIRT1蛋白
为了了解NMN如何影响老年人骨髓基质干细胞中NAP1L2水平,Liu和他的同事在实验室培养皿中用1mM浓度的NMN处理骨髓基质细胞。研究小组发现,有趣的是,NMN与NAP1L2蛋白对接,还减轻了衰老相关的β-半乳糖苷酶的积累。不仅如此,NMN治疗还减轻了衰老BMSC中端粒DNA损伤的积累。此外,用NMN处理细胞抑制SASP因子基因的表达。这些结果表明NMN至少在实验室培养皿中使BMSC恢复活力。如果这些发现在活的人类中有分量,这可能意味着随着人类年龄的增长,使用NMN可以恢复骨髓基质干细胞的“干性”,从而可能恢复成骨和缓解骨质疏松症。
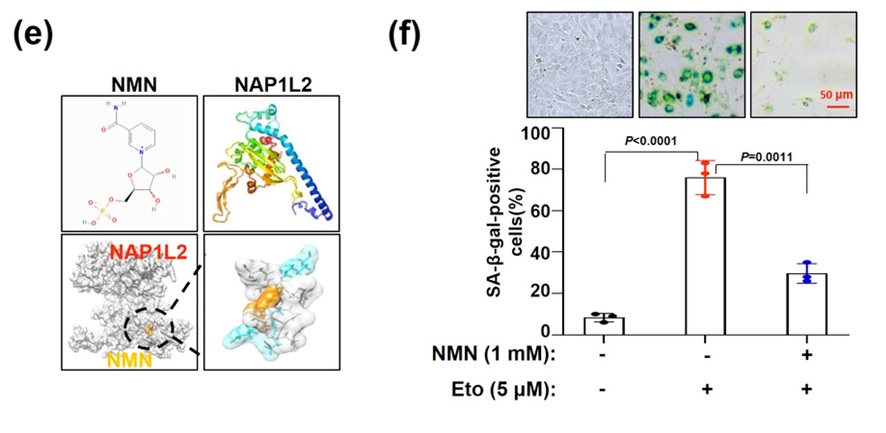
图示. NMN可防止骨细胞衰老的形成。结合NAP1L2的化合物的计算机建模识别NMN(左)。化疗剂依托泊苷(Eto)给药48小时以诱导细胞衰老。事实上,大约80%的骨髓干细胞(BMSC)变得衰老。在48小时期间用NMN处理相同的细胞使衰老细胞的百分比减少了约50%(右图)。
证实这一观点的进一步证据来自一项人类临床试验,表明NAP1L2水平升高与老年人骨质疏松症相关。例如,NAP1L2的表达与骨密度呈负相关,这意味着随着年龄的增长和NAP1L2水平的增加,骨骼变得更加多孔。尽管还需要进一步的测试,但补充NMN仍有可能增加人类的骨密度,使骨骼更强壮。
结语
NMN试剂的前景意味着,随着年龄的增长,人类可以从补充该化合物中受益,从而有可能逆转虚弱指数得分。通过这样做,我们可以过上更健康的生活,并有望减轻老年人的忧心和绝望。也许通过改善整体幸福感,服用NMN的老年人可以有更好的人生观,提供一个潜在的乐观来源。
来源:本网编辑 2024.04.10.
参考文献:
Hu M et al. NAP1L2 drives mesenchymal stem cell senescence and suppresses osteogenic differentiation. Aging Cell. 2022 Jan 15:e13551.