导言:最近的一项研究显示,烟酰胺腺嘌呤二核苷酸(NAD+)的恢复限制了沃纳综合征(成人型早老症)的线粒体功能障碍和衰老。该研究项目由美国国立卫生研究院(NIH)、挪威和丹麦等科学家共同完成。
研究表明,一种称为自噬的细胞过程在衰老中起着作用,它需要清除细胞中的碎片和功能失调的细胞成分(细胞器)。为了保持健康的稳态平衡,细胞经常通过这个过程处理和回收细胞器。在自噬过程中,细胞结构(自噬体)将小蛋白质和细胞器靶向到细胞的“垃圾箱”(溶酶体)。事实上,细胞器的降解和再循环(自噬过程)随着年龄的增长而减少。此外,热量限制等长寿方案与自噬的改善有关。
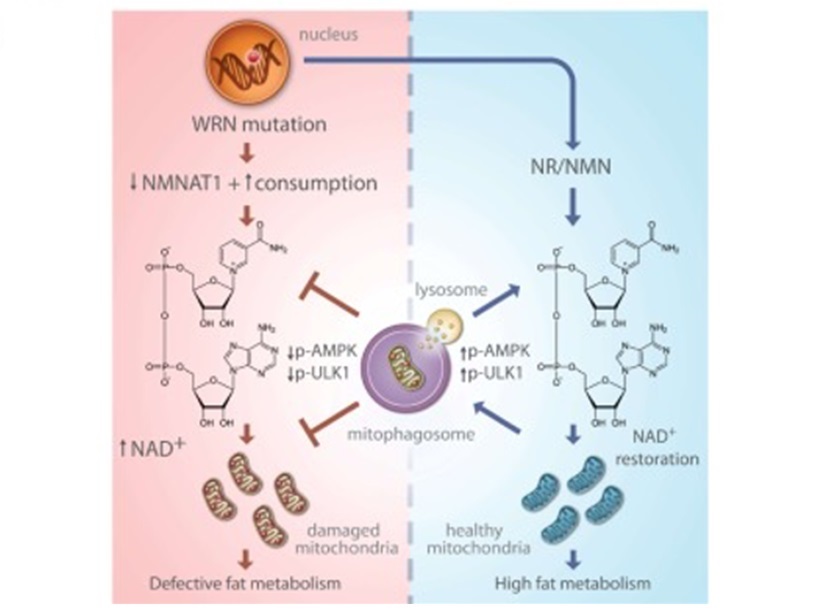
图源:Fang
et al. Nat Commun 2019
线粒体自噬是细胞中线粒体降解和循环的一种自噬。线粒体自噬过程受损可能导致线粒体功能障碍随着年龄的增长而增加。科学家们在研究中提出,沃纳综合征是一种导致衰老加速的疾病,其疾病过程(病因学)涉及“线粒体稳态失调”。换言之,研究小组认为,沃纳综合征具有线粒体过程功能失调的特性。该小组提出(假设)线粒体自噬随着年龄的增长而减少,以促进线粒体功能失调。为了验证这一点,该小组使用秀丽隐杆线虫作为沃纳综合征的模型。该组还包括来自沃纳综合征患者的细胞(成纤维细胞)进行测试。
科学家们发现,与健康人的细胞相比,沃纳综合征患者的细胞具有不健康的特征,包括线粒体受损。在研究的第一部分,该团队希望将沃纳综合征的线粒体功能障碍与健康细胞的线粒体进行比较。该团队使用沃纳综合征患者的细胞(成纤维细胞)与健康人的细胞(成纤维细胞)进行比较。与健康个体的成纤维细胞线粒体相比,来自沃纳综合征患者的成纤维细胞线粒体具有不健康的特征。线粒体不健康特征的测量包括与健康个体的成纤维细胞相比,沃纳综合征成纤维细胞的线粒体膜电位较低(表明通透性较大),线粒体含量较高,能量分子(ATP)减少。利用电子显微镜,科学家们发现,与健康人的成纤维细胞相比,沃纳综合征患者的成纤维细胞线粒体受损。然后,该小组在线虫模型秀丽隐杆线虫中进行了类似的实验,并发现与健康线虫相比,沃纳综合征模型线虫的线粒体结果相似。
研究小组发现,与健康人相比,沃纳综合征患者的血浆NAD+水平平均低58%。科学家们测量了沃纳综合征成纤维细胞与健康个体成纤维细胞的NAD+水平。与健康线虫相比,沃纳综合征模型线虫获得了类似的NAD+水平结果。
用烟酰胺核糖(NR)或烟酰胺单核苷酸(NMN)处理后,沃纳综合征模型线虫的寿命几乎提高到健康线虫的寿命。科学家们首先要问,在沃纳综合征动物模型中,补充NAD+是否会限制加速衰老。患有沃纳综合征的线虫(秀丽隐杆线虫-维尔纳综合症模型)和健康线虫用NAD+前体NR治疗。该小组还用NAD+前体NMN治疗沃纳综合征模型线虫。NMN治疗与NR治疗具有相似的抗衰老益处。
在沃纳综合征线虫中,用NR和NMN治疗可提高NAD+水平,并将线粒体自噬提高到正常水平。科学家们认为,沃纳综合征中NAD+水平下降导致的线粒体自噬受损会导致线粒体自噬减少。他们认为,线粒体自噬减少有助于沃纳综合征中受损线粒体的存在,因为线粒体自噬可以清除受损的线粒体。为了测试这一点,该小组使用了沃纳综合症模型蛔虫。他们的数据显示,与正常蛔虫相比,该模型蛔虫肌肉细胞的线粒体自噬减少了41%。
研究表明,沃纳综合征与线粒体功能障碍有关,主要表现为线粒体自噬缺陷。用NAD+补充剂NR和NMN治疗沃纳综合征模型生物体和人类细胞,可以改善线粒体自噬并延长寿命。Fang等人(2019)表示,“补充NAD+可改善线粒体功能和其他与年龄相关的代谢结果。”线粒体健康可能是考虑衰老干预措施的新目标。
来源:本网编辑 2024.04.06.
主要参考来源:
Fang EF et al. NAD+ augmentation restores mitophagy and limits accelerated aging in Werner syndrome. Nat Commun. 2019 Nov 21;10(1):5284.
其他参考文献:
1. Elayne
M et al. Mitophagy in neurodegeneration and aging. Neurochem Int. 2017
Oct:109:202-209.
2. Madeo
F et al. Can autophagy promote longevity? Nat Cell Biol. 2010 Sep;12(9):842-6.
3. Zhang
R et al. Short-term administration of Nicotinamide Mononucleotide preserves
cardiac mitochondrial homeostasis and prevents heart failure. J Mol Cell
Cardiol. 2017;112:64-73.
4. Gomes
AP et al. Declining NAD(+) induces a pseudohypoxic state disrupting
nuclear-mitochondrial communication during aging. Cell. 2013;155(7):1624-1638.