导言:烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)等前体进入细胞和在细胞内的途径略有不同,以提高NAD+水平。
不同的分子,只有几个原子的不同,通过细胞内外的不同受体和酶传递和转化,产生重要分子烟酰胺腺嘌呤二核苷酸(NAD+)。但是,这些不同的NAD+前体,其原子的结构差异可以通过其化学式中的一个字母或化学名称中的一个单词来区分,但它们并非都是平等的。
研究表明,饮用或食用含有这些代谢中介物的食物,或通过补充剂(无论是食用还是注射),即使它们都参与同一途径,对NAD+水平、细胞、组织和身体健康和功能的影响也不尽相同。它们所需的剂量和有效性可能部分取决于这些NAD+前体如何被不同的酶转化,以及它们是否能进入细胞。
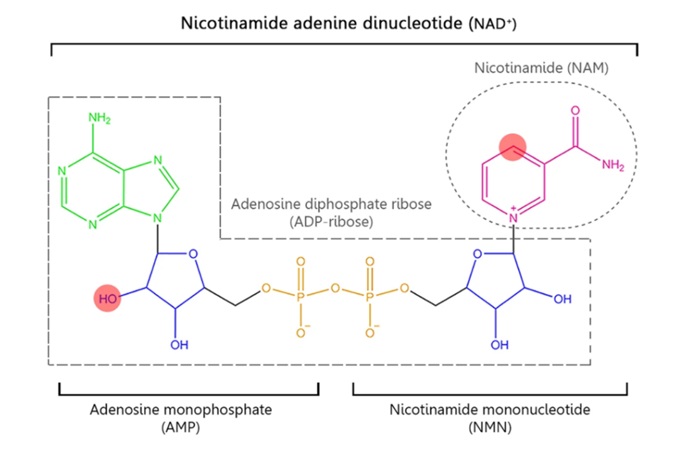
图1.(图源:Navas et al. 2021)NAD+结构。与NMN相连的一磷酸腺苷(AMP)形成NAD+。AMP由腺苷(绿色)、核糖环(蓝色)和磷酸基团(橙色)形成。NMN由核糖环、磷酸基团和烟酰胺(NAM)(粉红色)形成,负责氧化还原NAD+功能。
NAD+前体与挽救途径
有几种途径可以产生NAD+。尽管如此,其中一种被称为挽救途径(Salvage pathway),因为它在哺乳动物细胞中含量最高(其他途径被称为Preiss-Handler途径,其中NAD+由烟酸合成,从头合成途径,从色氨酸开始)。
挽救途径的工作原理是基于NAD+不断翻转的概念。本质上,它是一种NAD+循环途径。当NAD+被酶消耗时,通常参与包括DNA修复、代谢和细胞死亡在内的生理过程,它作为副产物转化为烟酰胺(NAM)。
挽救之路只有两步。在这第一步中,NAM的转化主要决定了该途径中NAD+合成为烟酰胺单核苷酸(NMN)的速率。然后,在第二步骤中将NMN转换为NAD+。总之,为了维持NAD+水平,NAM可以通过回收途径转化为NMN,再循环回NAD+。
除了NAM,NMN还可以由另一种称为烟酰胺核糖(NR)的NAD+前体产生。NR不是由NAD+消耗产生的NAM再循环,而是在细胞内通过一种名为烟酰胺核糖侧激酶(NRKs)的酶家族转化为NMN。
NMN和NR具有不同的细胞转运机制
为了制造NAD+,细胞最终需要获得NMN。细胞至少有两种方法可以做到这一点:(1)通过吸收在细胞内转化为NMN的NR,或(2)直接吸收NMN。
NR通过称为平衡核苷转运体(ENTs)的非特异性通道被掺入细胞。研究表明,ENT家族成员蛋白ENT1、ENT2和ENT4可以将细胞外NR和广泛的类似化合物导入培养的人类细胞中。ENT1和ENT2存在于大多数细胞类型和组织中,ENT4位于大脑和心脏。
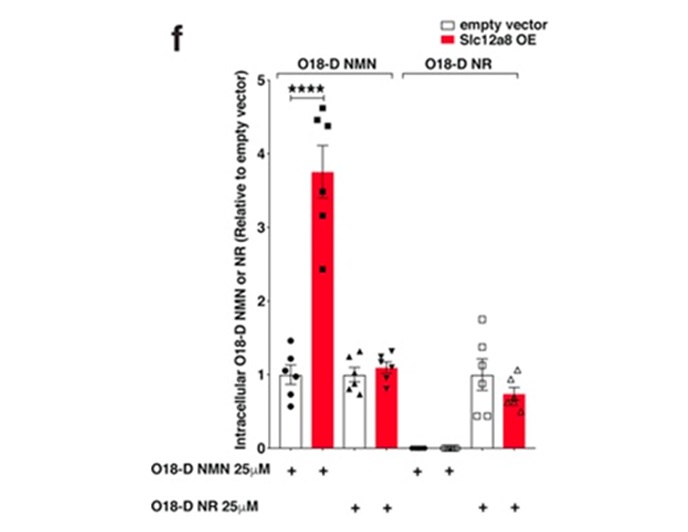
最近的一项研究发现了一种名为Slc12a8的NMN特异性转运蛋白。有趣的是,Slc12a8在小肠中被大量发现,这表明它是通过食物或补充摄入NMN的一种手段。更重要的是,在这项研究中,老年小鼠小肠中的Slc12a8水平随着NAD+的减少而增加。这表明随着年龄的增长,补充NMN是提高NAD+水平的一种可行方法。
此外,已经表明,一些NMN在细胞外通过一种名为CD73的酶转化为NR,然后这种NR可以通过细胞内的NRK转回NMN。也就是说,结果清楚地表明NMN在细胞外没有任何转化为NR的情况下被摄取。
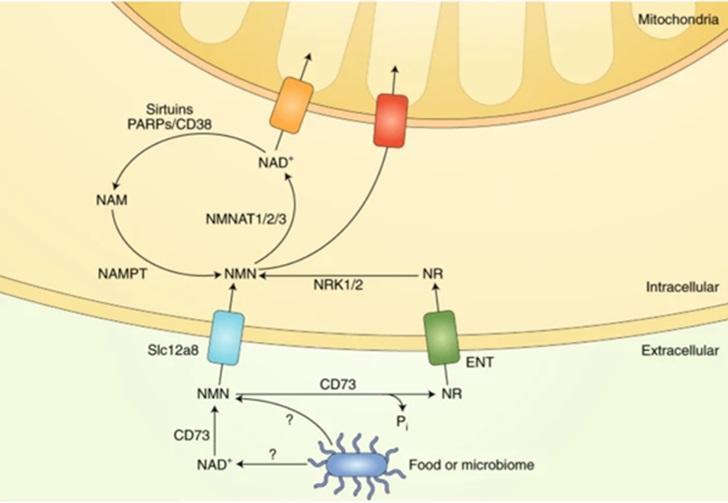
图2.(图源:Wu & Sinclair 2019)Slc12a8是一种NMN转运蛋白。Slc12a8对NMN具有高度选择性,甚至排除了与NMN仅相差一个原子的烟酸单核苷酸(NaMN)。NMN也可以在被细胞通过平衡核苷转运蛋白(ENTs)吸收之前转化为NR。然后通过烟酰胺核糖侧激酶1和2(NRK2/3)将NR转化回NMN。
NAD+的从头合成+
此外,一些细胞(主要在肝脏中)可以从多种饮食来源从头合成(De Novo,拉丁语)NAD+。NAD+可以通过犬尿氨酸途径从L-色氨酸中从头产生,也可以通过Preiss-Handler途径从维生素前体如烟酸(NA)从头产生。
值得注意的是,从头合成途径对NAD+水平的相对贡献仍不清楚。在肝脏外,大多数细胞不表达通过犬尿氨酸途径将色氨酸转化为NAD+所需的全部酶。大多数色氨酸在肝脏中代谢为NAM,在肝脏中释放到血清中,被外周细胞吸收,并通过NAM挽救途径转化为NAD+。
此外,在某些情况下,免疫细胞如巨噬细胞,也会从色氨酸中产生NAD+。因此,除了肝脏之外,从头生物合成途径似乎是一种更间接的机制,有助于全系统NAD+水平,其中大多数NAD+来自NAM挽救途径。
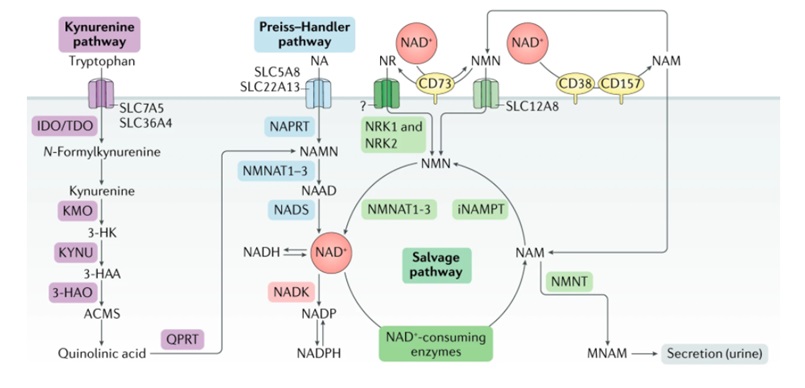
图3(图源:Covarrubias et al 2020)NAD+生物合成途径。NAD+水平由三种独立的生物合成途径维持。犬尿氨酸途径(或从头合成途径)利用膳食氨基酸色氨酸产生NAD+。色氨酸通过转运蛋白SLC7A5和SLC36A4进入细胞。Preiss–Handler途径使用膳食烟酸(NA),其通过SLC5A8或SLC22A13转运蛋白进入细胞。NAD+回收途径回收烟酰胺(NAM),该烟酰胺是消耗NAD+的酶的酶活性的副产物。NAM也可以被烟酰胺N-甲基转移酶(NNMT)修饰并通过尿液分泌。在细胞外,NAM作为胞外酶CD38和CD157的副产物产生并转化为NMN。CD73然后将NMN转化为烟酰胺核糖(NR),通过未知的核苷转运蛋白转运到细胞中(问号)。NMN可以通过NMN特异性转运蛋白(小肠中的SLC12A8)导入细胞。在细胞内,NR通过烟酰胺核糖侧激酶1和2(NRK1和NRK2)形成NMN。NMN然后通过NMNAT1、NMNAT2和NMNAT3转换成NAD+。
衰老与NAD+代谢
NAD+在细胞中不断合成、消耗和循环,以保持细胞中NAD+的稳定水平。然而,在衰老过程中,NAD+的合成和消耗过程之间的这种平衡可能会发生变化,NAD+降解可能超过细胞从头产生NAD+的能力或有效回收或挽救NAM的能力。此外,过量的NAM可能通过替代代谢途径被消耗,有效地将其从NAM挽救途径转移出去,并进一步影响NAD+水平。
通过补充NAD+水平下降的治疗靶点
好消息是,NMN和NR等前体提高人体NAD+水平的证据越来越多。一些人体临床试验正在进行中,以评估NAD+增强的安全性和有效性。重要的是,短期NAD+前体给药的早期试验已证明是安全的,并可提高健康参与者的NAD+水平。
然而,尽管初步结果很有希望,但长期补充NAD+前体是否有任何副作用仍然未知。此外,还需要回答许多其他问题,以加深人们对NAD+增强疗法潜力的理解:NMN和NR是否具有组织/疾病特异性?不同疾病所需的NAD+前体的治疗剂量是多少?
使用NAD+前体,如NMN和NR,为治疗衰老相关疾病和延长人类健康寿命提供了一种令人兴奋的治疗方法。这一点尤为重要,因为老年人口正在迅速增长,预计未来几十年与老龄化相关的情况将造成巨大的社会和经济负担。希望当前临床试验即将得出的结果能为我们尚未解决的问题提供一些线索,并为未来破解NAD+在人类衰老过程中的作用奠定基础。
来源:本网编辑 2024.03.12.
参考文献:
1. Covarrubias AJ et al. NAD+ metabolism and its roles in cellular processes during ageing. Nat Rev Mol Cell Biol. 2021 Feb;22(2):119-141.
2. Grozio A et al. Slc12a8 is a nicotinamide mononucleotide transporter. Nat Metab. 2019 Jan;1(1):47-57.
3. Navas LE et al. NAD+ metabolism, stemness, the immune response, and cancer. Signal Transduct Target Ther. 2021 Jan 1;6(1):2.
4. Wu LE, Sinclair DA. The elusive NMN transporter is found. Nat Metab. 2019 Jan;1(1):8-9.