目录:
1.NMN定义
2.NMN来源
2.1.内源性合成
2.2.食物来源
6.1.NAD+激活Sirtuins
6.2.NAD+在线粒体中的辅酶功能
6.3. NAD+有助于控制DNA损伤
7.NMN潜在益处
7.1.关于NMN人体研究
7.2. NMN与衰老
7.3. NMN与炎症
7.4. NMN与神经变性
7.5. NMN与代谢障碍
7.6. NMN与心脏功能
7.7. NMN与免疫系统
8.副作用和安全性
10. NMN展望
11.参考文献
烟酰胺单核苷酸(β-Nicotinamide mononucleotide,NMN)天然存在于所有生命形式的每个活细胞中。在分子水平上,它属于一类核苷酸,核苷酸是RNA和DNA组成单位。在结构上,NMN由三个主要化学基团组成:磷酸基团、核糖和烟酰胺碱(如图1)。NMN有二种不规则存在形式,α-和β-,β-异构体是NMN的活性形式;NMN化学式为C11H15N2O8P,分子量334.221。NMN易溶于水,非油溶性。
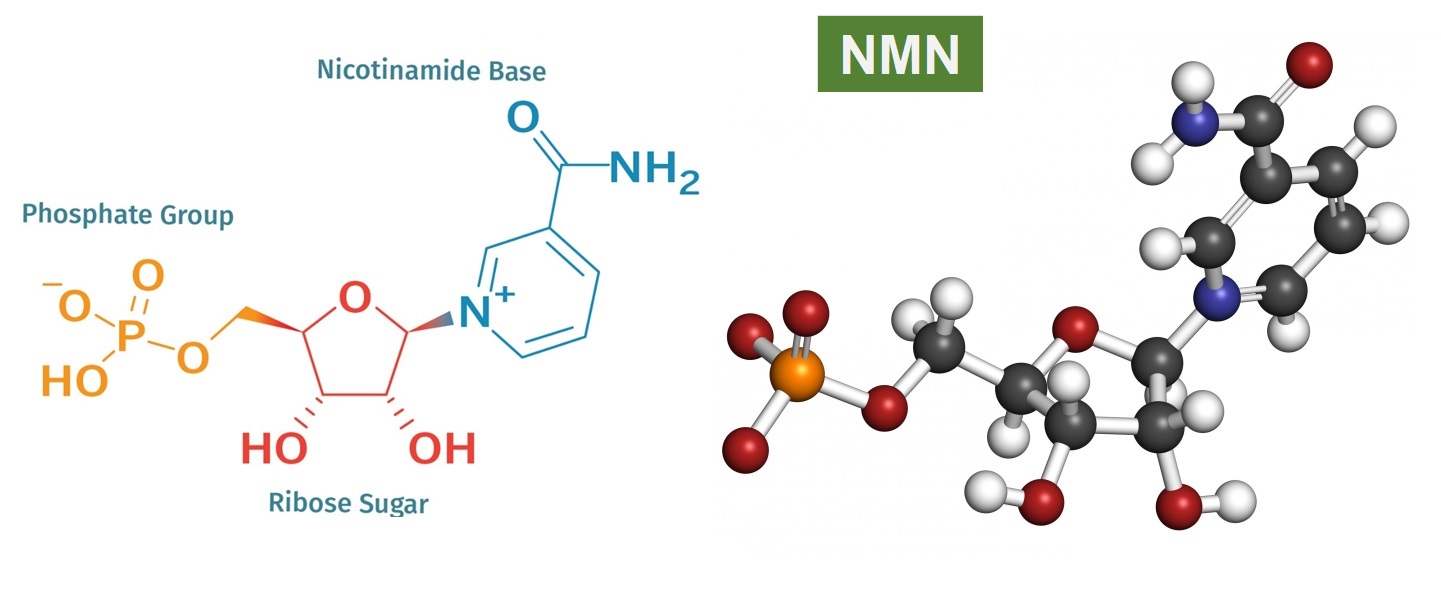
图1. NMN的化学结构式和球棍模型(图源:互联网)
NMN是 烟酰胺腺嘌呤二核苷酸(NAD+,又称辅酶I)合成的关键前体,它直接转化为NAD+以提高其水平。因此,NMN有时被称为NAD+增强剂(如图2)。NAD+存在于有机体的每个细胞中充当辅酶,参与能量代谢,基因表达和线粒体功能调节等重要过程2,3。一些证据表明,补充NAD+前体(包括NMN)可以增加NAD+的合成,这可能对整体健康和衰老产生积极影响2。
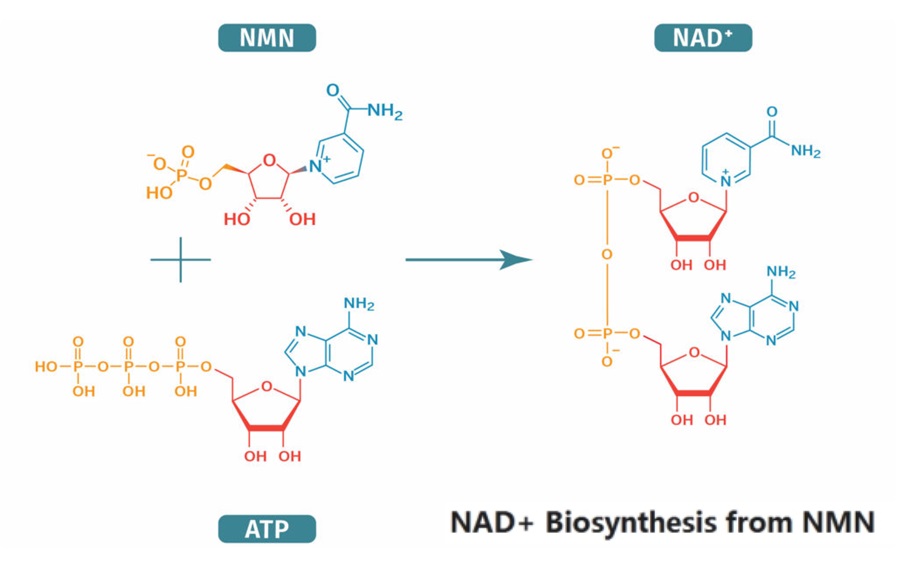
图2. NAD+由NMN生物合成(图源:互联网)
由于NAD+这种重要化合物的产量减少和消耗增加,其水平自然会随着年龄的增长而下降。NAD+不足可能会对衰老过程中的健康状况产生负面影响,并可能增加与年龄相关的疾病的风险,如2型糖尿病和老年痴呆(阿尔茨海默病)4。
了解NMN有关产品形式、服用注意事项和购买路径等,可点击:烟酰胺单核苷酸(概述)>>
NMN来源
2.1.内源性合成:
NMN是天然存在的物质,由体内的B族维生素产生,通常有二条合成路径:一分子烟酰胺(NAM,维生素B3衍生物)和一分子5-磷酸核糖基-1-焦磷酸(PRPP)在烟酰胺磷酸核糖转移酶(NAMPT)催化作用下生成一分子NMN和一分子焦磷酸(PPi)。此外,一分子烟酰胺核糖(NR)在烟酰胺核苷激酶(NRK)催化下磷酸化生成一分子NMN5。如图3。
“NAMPT”是NAD+产生过程中的限速酶,它在体内无所不在,但组织间表达水平存在较大差异。因此,较低水平的NAMPT会导致NMN产量下降,造成NAD+水平降低5。补充NMN等前体分子也可以加快NAD+的产生。
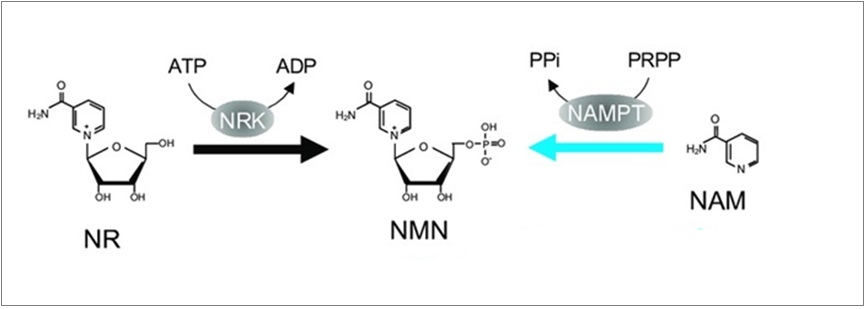
图3. NMN体内合成(图源:互联网)
2.2.食物来源:
NMN在果蔬、肉类等许多食物中都广泛存在,只是含量极少、差别大6,如下表:
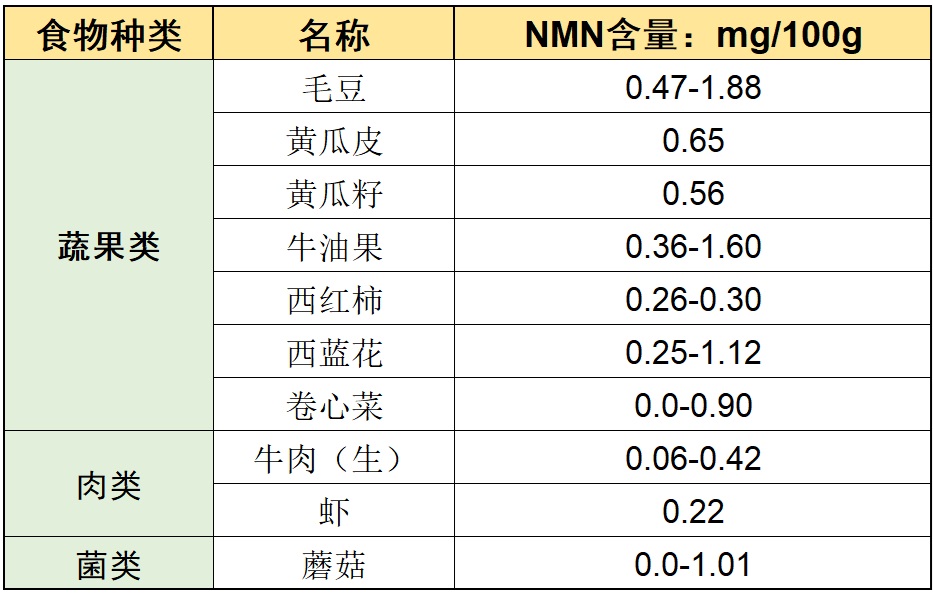
NMN在一些常见食物的含量
曾经认为NMN在进入细胞之前必须改变,但新的证据表明,它可以通过某些细胞膜中的特异性转运蛋白直接进入细胞7,已知有两种进入细胞的方式:
3.1. 通过转运体直接进入细胞:2019年《自然-代谢》(Nat Metab)上的一篇文献证实,小鼠小肠内有一种名为Slc12a8的特异性转运蛋白,对NMN有很高的选择性,且不转运与NMN结构相似的NaMN7。
3.2. 通过细胞膜表面的CD73去磷酸化为NR(通过平衡核苷转运蛋白ENTs)进入细胞内,随后再通过细胞质的NRK酶催化为NMN,进入线粒体被利用(线粒体无NRK)8。
烟酰胺(NAM)既是NMN的前体,又是NAD+经NADase活性消耗途径CD38水解后的产物。因此,NAD+的合成、利用、再生是一个涉及胞内胞外的NMN/NR→NAD+→NAM→NMN的循环。如图4所示。
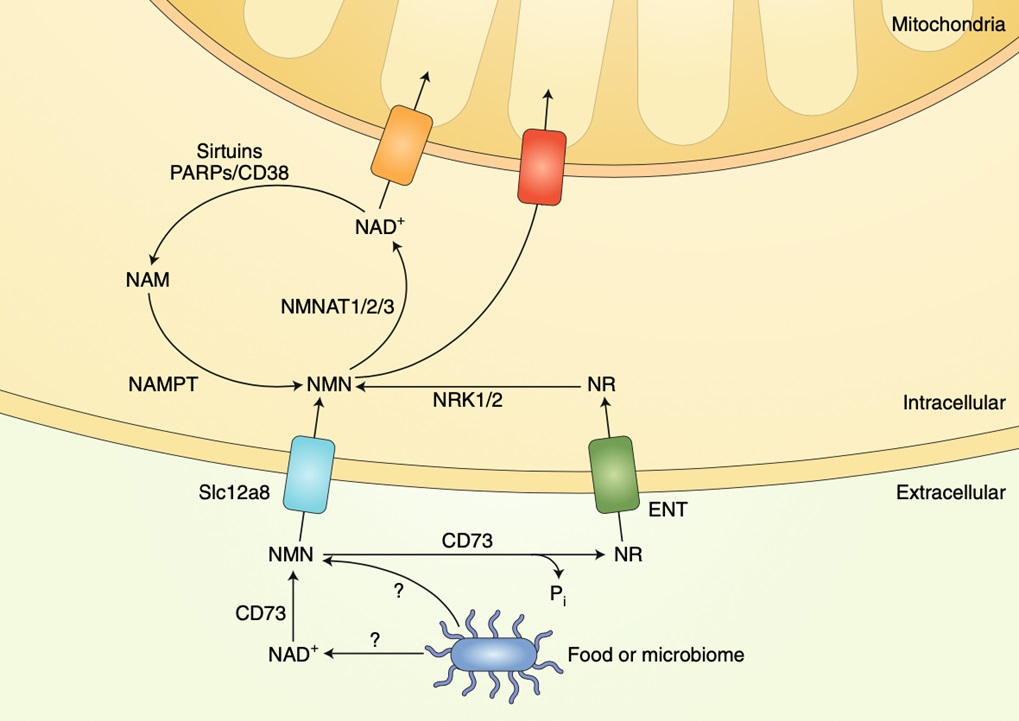
图4. NMN如何进入细胞(图源:互联网)
虽然不能在血清中检测到完整结构的NMN,但喂食NMN后可很快(15min)提高雌性、雄性小鼠的肝脏NAD+水平9,如图5。
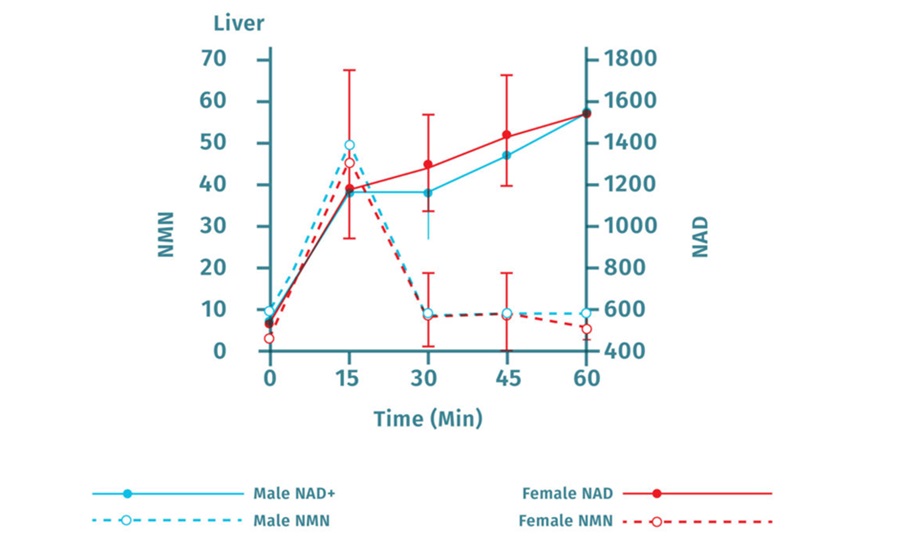
图5. 喂食小鼠NMN后15分内可增加肝脏NAD+水平(图源:Yoshino J et al 2011)
此外,注射NMN会导致身体许多区域的NAD+增加,包括胰腺、脂肪组织、心脏、骨骼肌、肾脏、睾丸、眼睛和血管等10。
NMN分子比NAD+小,可以更有效地被细胞吸收。NAD+不能轻易进入细胞,因为细胞膜提供了屏障,在没有转运蛋白的情况下可阻止离子、极性分子和大分子进入。随着时间的推移,正常细胞功能消耗NAD+供应,细胞内NAD+浓度随着衰老而降低。人们认为通过补充NAD+前体可以恢复NAD+的健康水平。然而,根据研究,NMN和烟酰胺核糖(NR)等前体被视为NAD+产生的补充,从而增加NAD+的浓度11。
著名的哈佛大学NAD+研究者David Sinclair表示,“直接给生物体喂食或给予NAD+不是一个切实可行的选择。NAD+分子无法轻易穿过细胞膜进入细胞,因此无法对代谢产生积极影响。相反,必须使用NAD+的前体分子来提高NAD+的生物利用水平。”这意味着NAD+不能用作直接补充剂,因为它不容易被吸收。NAD+前体比NAD+更容易被吸收,是更有效的补充剂11。
机体可从较小的成分或前体中自然产生NAD+。体内存在五种主要的NAD+前体:色氨酸、烟酰胺(Nam)、烟酸(NA)、烟酰胺核糖(NR)和烟酰胺单核苷酸(NMN)。其中,NMN代表NAD+合成的最后步骤12,13。
这些前驱物都可以来自饮食中。Nam、NA和NR都是维生素B3的形式,维生素B3是一种重要的营养素。一旦进入体内,细胞就可以通过几种不同生化途径合成NAD+。生化途径相当于工厂生产线,多条生产线都能生产出相同的产品即NAD+。
这些途径中的第一条被称为从头途径(De novo)。从头是一个拉丁语表达,相当于“从头开始”。从头途途径始于最早的NAD+前体色氨酸,并从那里向上构建12,13。如图6。
第二条路径称为挽救途径。挽救途径类似于回收,因为它从NAD+降解的产物中产生NAD+。体内的所有蛋白质都需要定期降解,以防止它们积累到不健康的程度。作为这个生产和降解循环的一部分,酶会获取蛋白质降解的一些结果,并将其直接放回同一蛋白质的生产线12,13。如图6。
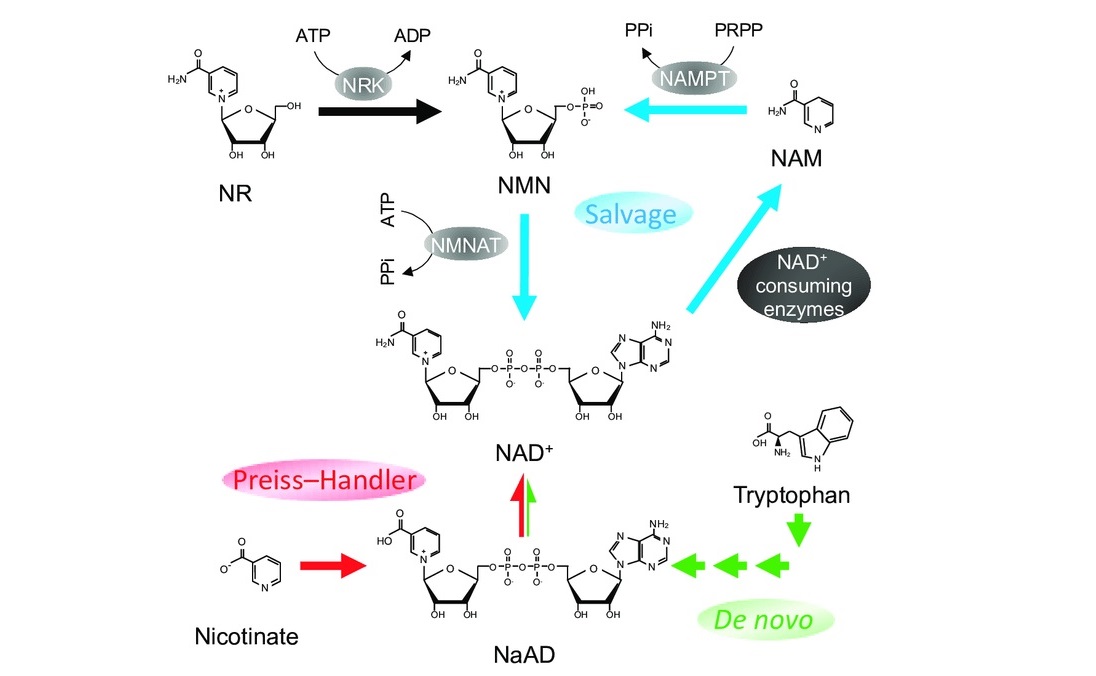
图6. NAD+在体内的三种生物合成途径(图源:互联网)
研究发现,NAD+是体内最丰富的、生命活动所必需的分子之一。NAD+是一种辅酶,是细胞内的各种酶发挥作用所需的“辅助”分子。酶是一种特殊类型的蛋白质,能使化学反应更快。如果没有酶,生命很可能不存在。
重要的是,随着年龄的增长,以及在肥胖、心血管疾病、神经退行性疾病和少肌症(与年龄相关的肌肉萎缩)等慢性疾病的情况下,NAD+都会下降。因此,补充NMN等NAD+前体以恢复NAD+水平,有可能减轻衰老的不良影响,甚至预防或逆转慢性疾病。目前,越来越多的科学证据支持在动物模型和人类中提高NAD+的抗衰老和促进健康老化作用。
6.1.NAD+激活Sirtuins
NAD+为一类关键的酶提供燃料,这种酶被称为Sirtuins(又称长寿蛋白)。有些研究人员认为Sirtuins是 “细胞守护者”,因为它们在修复DNA和支持线粒体健康方面发挥着积极作用14。线粒体是细胞的动力来源,为生命体活动提供绝大部分的能量(ATP)。不健康的线粒体产生较少的ATP,从而导致细胞死亡。由于过度的DNA损伤也会导致细胞死亡,Sirtuins通过修复DNA和保持线粒体的原始状态来促进细胞存活14,15。
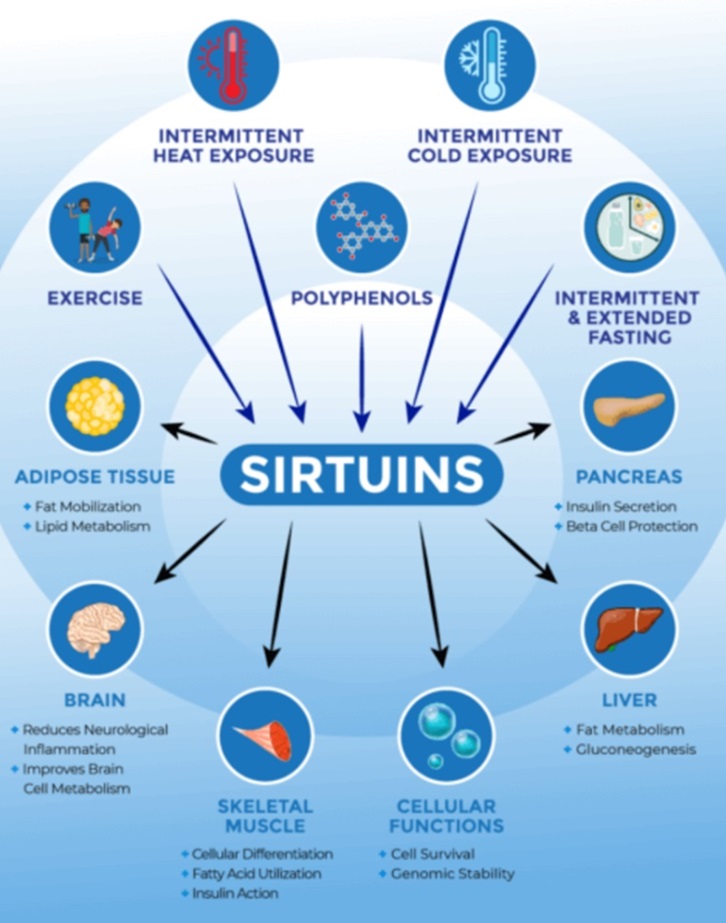
图7. Sirtuins与健康长寿关系(图源:互联网)
除了NMN,多酚类(促进长寿的植物化学素如白藜芦醇)、运动和热量限制(如各种间歇性断食)15,在非营养不良的情况下摄入更少的热量也可以提高NAD+水平并激活Sirtuins,见图7。在小鼠中,由于热量限制而增加的NAD+和Sirtuin活性已被证明可以减缓衰老过程16。除了提高细胞存活率和保护DNA(基因组稳定性)外,Sirtuins还提供多种益处。Sirtuins通过改善胰腺的胰岛素分泌、促进肝脏的脂肪代谢和提高肝脏葡萄糖的产生来预防糖尿病和脂肪肝;Sirtuins还可以防止肌肉减少、神经退行性变和脂肪组织增加17。
6.2.NAD+在线粒体中的辅酶功能
NAD+在代谢过程中发挥着特别积极的作用,如糖酵解、TCA循环(又名克雷布斯循环或柠檬酸循环)和电子传递链18。电子传递链发生在线粒体中,是机体获得细胞能量的方式。
NAD+作为配体与酶结合,并在分子之间转移电子。电子是细胞能量的原子基础,通过将它们从一个分子转移到下一个分子,NAD+通过类似于给电池充电的细胞机制发挥作用。当电子被消耗来提供能量时,电池就会耗尽。如果没有这个助推,这些电子就无法返回到它们的起点。在细胞中,NAD+起到助推器作用。通过这种方式,NAD+可以降低或增加酶活性、基因表达和细胞信号传导18,19。
6.3.NAD+有助于控制DNA损伤
随着生物体年龄的增长,由于辐射、污染和不精确的DNA复制等内外因素,它们会对DNA造成损伤。根据目前的衰老理论,DNA损伤的积累是导致衰老的主要原因。几乎所有的细胞都含有修复这种损伤的“分子机制”。这种机制消耗NAD+和能量分子。因此,过度的DNA损伤会耗尽宝贵的细胞资源19。
一种重要的DNA修复蛋白PARP(聚ADP核糖聚合酶)依赖NAD+发挥作用21。老年人的NAD+水平下降。正常衰老过程中DNA损伤的积累导致PARP增加,从而导致NAD+浓度降低22。线粒体中任何进一步的DNA损伤都会加剧这种消耗。
7.1.关于NMN人体研究
NMN的大量研究已经在小鼠和大鼠身上进行。这些对新陈代谢,肝脏,皮肤,肌肉和大脑功能以及改善骨骼结构,血管健康,生殖,免疫系统功能和寿命都有积极影响。关于补充NMN的人体研究尚处于早期阶段,因此数据仍然有限。
2020年,一家日本实验室对NMN进行了人体临床试验,结果表明,单剂量给药时,其耐受性良好23。2021年的一项研究结果表明,NMN可以提高业余跑步者的有氧能力24。虽然这项研究存在一些局限性,但改进后可衡量。
另一项2021年的人体研究表明,NMN改善了糖尿病前期女性的肌肉葡萄糖代谢,并产生了临床相关结果25。
2022年5月,一项多中心NMN临床试验的数据发表了一些适度但有趣的结果26。数据表明,NMN正在增加能量水平,可以解释为抗衰老作用,尽管在这种情况下相对较小。也就是说,不服用NMN的安慰剂参与者的NAD+水平也有所增加。这些结果需要进一步的调查和更大规模的研究,因为这项研究规模很小,只有66人。
7.2.NMN与衰老
与年龄相关的NAD+下降不仅是衰老的症状,而且是与之相关的生理恶化的促成因素。随着年龄的增长,这些NAD+水平的下降会损害基本的细胞功能,包括能量代谢,DNA修复和基因组稳定性1,6。这种损害是衰老的关键驱动因素,与年龄相关疾病的发展密切相关。
最近对小鼠的研究揭示了NMN不仅可以提高NAD+水平,还可以增强线粒体功能27,这在衰老细胞中经常受到损害。线粒体是细胞的动力,对能量产生至关重要,其功能障碍是衰老的标志。通过提高NAD+水平,NMN可以增强线粒体活性,从而潜在地缓解与衰老相关的症状并改善细胞健康。
此外,补充NMN的意义不仅限于能源生产。在小鼠研究中,NMN在激活SIRT1(一种NAD+依赖性蛋白脱乙酰酶)等途径中的作用与各种健康益处有关。这些包括改善DNA修复,减少氧化应激和提高代谢效率,所有这些对于应对衰老的生物学挑战都至关重要。这些途径的激活突出了NMN作为全面抗衰老干预的潜力24。
7.3. NMN与炎症
报道NMN抗动脉粥样硬化作用的同一项研究也揭示了其在治疗慢性炎症性疾病方面的潜力。观察到NMN给药可降低血清丙二醛(MDA)水平,丙二醛是氧化应激的标志物,并增加抗氧化酶的活性。值得注意的是,它降低了促炎细胞因子的表达,同时增强了主动脉组织中抗炎因子的表达。这些结果表明,NMN减轻氧化应激和调节炎症反应的能力可能是解决各种慢性炎症状况的关键28。
另一项涉及人类细胞(包括肺微血管内皮细胞和冠状动脉内皮细胞)的研究表明,补充NMN可以减轻由双链RNA的合成类似物poly(I:C)诱导的炎症反应。这种作用部分归因于NMN暴露下主要炎症介质(包括IL6和PARP家族成员)的下调。这些发现说明了NMN在分子水平上影响炎症通路的能力29。
这些发现的影响是巨大的。对于慢性炎症,这通常是一个沉默而阴险的过程,会导致各种与年龄有关的疾病,NMN调节免疫反应和减少炎症标志物的潜力可能会改变游戏规则。这可能会导致治疗慢性炎症是关键组成部分的疾病的新方法,例如某些自身免疫性疾病、代谢综合征,甚至一些神经退行性疾病。
在急性炎症的背景下,通常是对损伤或感染的快速而强烈的反应,NMN的作用同样有希望。控制和限制急性炎症反应的能力可以增强恢复和愈合过程,潜在地降低组织损伤和瘢痕形成等并发症的风险30。
7.4.NMN与神经变性
在患有阿尔茨海默症的小鼠中,提高NAD+水平可以减少蛋白质的积累,而蛋白质的积累会破坏大脑中的细胞通讯,从而提高认知功能31。当流向大脑的血液不足时,提高NAD+水平也可以保护脑细胞免于死亡。许多动物模型研究为帮助大脑健康衰老、预防神经退行性变32和改善记忆力33提供了新的前景。
7.5.NMN与代谢障碍:
NAD+是维持线粒体健康功能和稳定能量输出的关键之一。衰老和高脂肪饮食会降低体内NAD+的水平34。研究表明,服用NAD+增强剂可以缓解小鼠与饮食相关和与年龄相关的体重增加,并提高其运动能力,甚至在老年小鼠中也是如此6。其他研究甚至逆转了糖尿病对雌性小鼠的影响,显示了对抗代谢紊乱(如肥胖)的新策略9。
7.6.NMN与心脏功能
提高NAD+水平可保护心脏并改善心脏功能35。高血压会导致心脏增大和动脉堵塞,从而导致中风。在小鼠中,NAD+增强剂补充了心脏中的NAD+水平,并防止了因缺乏血液流动而对心脏造成的损伤36。其他研究表明,NAD+增强剂可以保护小鼠免受异常心脏增大的影响37。
7.7.NMN与免疫系统
随着成年人年龄的增长,免疫系统下降,人们更容易生病,更难从季节性流感甚至新冠肺炎等疾病中恢复过来。最近的研究表明,在免疫反应和衰老过程中,NAD+水平在调节炎症和细胞存活方面发挥着重要作用。这项研究强调了NAD+对免疫功能障碍的治疗潜力38,39。
NMN被认为在动物身上是安全的,其结果很有希望,人类临床试验已经开始40。这种分子在很大程度上被认为是安全无毒的,即使在小鼠和人类研究中处于高浓度23。小鼠长期(一年)口服给药没有毒性作用。第一次人体临床试验已经完成,证据支持它单剂量无毒的观点。
尽管2019年11月发表的一项针对日本男性的研究指出,服用NMN后,受试者血液中的胆红素水平升高,但这些水平仍在正常范围内。未来的研究应侧重于使用的长期安全性和有效性。NMN与任何其他已知的副作用无关。
烟酰胺腺嘌呤二核苷酸,简称NAD,是人体内最重要、最通用的分子之一。因为它是为细胞提供能量的核心,所以几乎没有一个生物过程不需要NAD。因此,NAD成为广泛生物学研究的焦点。
1906年,Arthur Harden和William John Young在从啤酒酵母中提取的液体中发现了一种“因子”,可以促进糖发酵成酒精。这个“因子”,在当时被称为“共发酵物(Co-ferment)”,后来被证实是NAD。
Harden和Hans von Euler-Chelpin继续揭开发酵的奥秘。他们于1929年获得诺贝尔奖,因为他们对这些过程有了详细的了解,包括很快被称为NAD的化学形状和性质。
NAD的故事在20世纪30年代继续扩展,另一位诺贝尔获奖者Otto Warburg发现了NAD在促进许多生化反应中的核心作用,包括NAD发挥着电子的一种生物继电器作用。电子从一个分子转移到另一个分子,是进行所有生物化学反应所需能量的基础。
1937年,威斯康星大学麦迪逊分校的Conrad Elvehjem及其同事发现,补充NAD+可以治愈狗的黑舌病。在人类身上,黑舌病会引起一系列症状,包括腹泻、痴呆和口腔溃疡。它源于烟酸缺乏症,现在定期用烟酰胺治疗,已知烟酰胺是NMN的前体之一。
Arthur Kornberg在40年代到50年代对NAD+的研究使他发现DNA复制和RNA转录这两个对生命至关重要的过程背后的原理。
1958年,Jack Preiss和Philip Handler揭示了烟酸转化为NAD的三个生化步骤41。这一系列步骤被称为路径,今天命名为Preiss Handler路径(见上图6)。
1963年,Chambon、Weill和Mandel报道了烟酰胺单核苷酸(NMN)提供了激活一种重要核酶所需的能量42。这一发现为一种名为PARP的蛋白质的一系列引人注目的发现铺平了道路。PARP在修复DNA损伤、调节细胞死亡方面发挥着至关重要的作用,其活性与寿命的变化有关。
1976年,Rechteiner和他的同事发现了令人信服的证据,证明NAD+在哺乳动物细胞中似乎具有“其他一些主要功能”,超出了其作为能量转移分子的经典生化作用42。
这一发现使Leonard Guarente和他的同事有可能发现,一种名为Sirtuins的蛋白质通过不同地保持一些基因的“沉默”来利用NAD延长寿命43。
从那时起,人们对NAD及其中间体NMN和NR越来越感兴趣,因为它们有可能改善一些与年龄相关的健康问题,包括哈佛大学教授David Sinclair的NAD抗衰老研究44,45。
NMN已经在动物研究中显示出了很有前景的治疗特性,研究人员的目标是了解这种分子在人体中是如何工作的。
最近的临床试验主要证实了NMN补充剂在人体中的安全性和耐受性46。例如,涉及不同剂量的NMN每日口服给药的研究表明,NMN可以安全食用,不会产生显著的不良反应。这些试验的具体重点各不相同,从研究NMN对血液NAD+水平的影响到评估更广泛的健康结果,如认知功能、代谢健康和心血管健康。
这些试验的一个关键发现是补充NMN后血浆NAD+水平显著升高,这是NMN发挥有益作用的主要机制的基础。除了提高NAD+水平外,一些研究还报告了各种健康标志物的改善,包括身体表现增强、血液生物年龄稳定和整体健康评估得分提高。这些结果表明,NMN支持细胞健康,有助于改善整体健康,并可能延缓衰老的生理方面46。
然而,这些试验中出现的一个有趣的方面是个体对NMN补充剂反应的可变性。这种可变性突出了NMN影响的微妙方面,表明遗传、生活方式和基线健康状况等个体因素可能会影响人们对NMN的反应。这种可变性突出了NMN补充中个性化方法的重要性,表明未来的研究和应用可能需要根据个人需求和环境调整NMN剂量和方案。
这些试验证明,NMN的安全性特别令人鼓舞,增强了NMN作为长期使用补充剂的潜力。试验参与者即使在更高剂量下也没有显著的不良反应,这证明了NMN适合广泛使用46。
了解NMN有关产品形式、服用注意事项和购买路径等,:烟酰胺单核苷酸(概述)>>
来源:本网编辑 2024.03.16.首版
1. NLM Pubchem. Available at. https://pubchem.ncbi.nlm.nih.gov/compound/Nicotinamide-mononucleotide
2. Shade C. The science behind nmn–a stable, reliable nad+activator and anti-aging molecule. Integr Med (Encinitas). 2020;19(1):12-14..
3. Xie N et al. NAD+ metabolism: pathophysiologic mechanisms and therapeutic potential. Sig Transduct Target Ther. 2020;5(1):1-37
4. Mehmel M et al. Nicotinamide riboside—the current state of research and therapeutic uses. Nutrients. 2020;12(6):1616.
5. Shen Q et al. Biological synthesis of nicotinamide mononucleotide. Biotechnol Lett. 2021 Dec;43(12):2199-2208.
6. Mills KF et al. Long-Term Administration of Nicotinamide Mononucleotide Mitigates Age-Associated Physiological Decline in Mice. Cell Metab. 2016, 24, 795–806.
7. Grozio A et al. Slc12a8 is a nicotinamide mononucleotide transporter. Nat Metab. 2019 Jan; 1(1): 47–57.
8. Covarrubias AJ et al. NAD+ metabolism and its roles in cellular processes during ageing. Nat Rev Mol Cell Biol. 2021 Feb;22(2):119-141.
9. Yoshino J et al. Nicotinamide mononucleotide, a key NAD(+) intermediate, treats the pathophysiology of diet- and age-induced diabetes in mice. Cell Metab. 2011 Oct 5;14(4):528-36.
10. Zheng S-L et al. Distribution of Nicotinamide Mononucleotide after Intravenous Injection in Normal and Ischemic Stroke Mice. Curr Pharm Biotechnol. 2023;24(2):299-309.
11. Yang Y et al. NAD(+) metabolism: Bioenergetics, signaling and manipulation for therapy. Biochim Biophys Acta. 2016 Dec;1864(12):1787-1800.
12. Xie N et al. NAD+ metabolism: pathophysiologic mechanisms and therapeutic potential. Signal Transduct Target Ther. 2020 Oct 7;5(1):227.
13. Wikipedia. Available at. https://en.wikipedia.org/wiki/Nicotinamide_adenine_dinucleotide. Accessed on Mar 02, 2024
14. Shin-ichiro Imai et al. NAD+ and sirtuins in aging and disease. Trends Cell Biol. 2014 Aug;24(8):464-71.
15. Abbotto E et al. Virtual Screening in the Identification of Sirtuins’ Activity Modulators. Molecules. 2022; 27(17):5641
16. Hayashida S et al. Fasting promotes the expression of SIRT1, an NAD+ -dependent protein deacetylase, via activation of PPARalpha in mice. Mol Cell Biochem. 2010 Jun;339(1-2):285-92.
17. Grabowska W et al. Sirtuins, a promising target in slowing down the ageing process. Biogerontology. 2017; 18(4): 447–476.
18. Li W et al. NAD+ content and its role in mitochondria. Methods Mol Biol. 2015:1241:39-48.
19. Stein LR et al. The dynamic regulation of NAD metabolism in mitochondria. Trends Endocrinol Metab. 2012 Sep;23(9):420-8.
20. Croteau DL et al. NAD+ in DNA repair and mitochondrial maintenance. Cell Cycle. 2017; 16(6): 491–492.
21. Wilk A et al. Extracellular NAD+ enhances PARP-dependent DNA repair capacity independently of CD73 activity. Sci Rep. 2020 Jan 20;10(1):651.
22. Sas K et al. Mitochondria, Oxidative Stress and the Kynurenine System, with a Focus on Ageing and Neuroprotection. Molecules. 2018 Jan 17;23(1):191.
23. Irie J et al. Effect of Oral Administration of Nicotinamide Mononucleotide on Clinical Parameters and Nicotinamide Metabolite Levels in Healthy Japanese Men. 2020 Feb 28;67(2):153-160.
24. Liao B et al. Nicotinamide Mononucleotide Supplementation Enhances Aerobic Capacity in Amateur Runners: A Randomized, Double-Blind Study. J Int Soc Sports Nutr. 2021 Jul 8;18(1):54.
25. Yoshino M et al. Nicotinamide Mononucleotide Increases Muscle Insulin Sensitivity in Prediabetic Women. Science 2021 Jun 11;372(6547):1224-1229.
26. Huang H. A Multicentre, Randomised, Double Blind, Parallel Design, Placebo Controlled Study to Evaluate the Efficacy and Safety of Uthever (NMN Supplement), an Orally Administered Supplementation in Middle Aged and Older Adults. Frontiers in aging. 2022 May 5:3:851698.
27. He S et al. Nicotinamide mononucleotide alleviates endotoxin-induced acute lung injury by modulating macrophage polarization via the SIRT1/NF-κB pathway. Pharm Biol. 2024 Dec;62(1):22-32
28. Wang Z et al. Nicotinamide Mononucleotide Protects against High-Fat-Diet-Induced Atherosclerosis in Mice and Dampens Aortic Inflammation and Oxidative Stress. J Funct Foods. Jan 2024;112.105985
29. Sano H et al. Nicotinamide Mononucleotide (NMN) Alleviates the Poly(I:C)-Induced Inflammatory Response in Human Primary Cell Cultures. Scientific Reports 2023 13:1 2023, 13, 1–12
30. Liang Y et al. Temperature-Sensitive Hydrogel Dressing Loaded with Nicotinamide Mononucleotide Accelerating Wound Healing in Diabetic Mice. Biomed Pharmacother. 2023 Nov:167:115431.
31. Johnson S et al. CA1 Nampt knockdown recapitulates hippocampal cognitive phenotypes in old mice which nicotinamide mononucleotide improves. NPJ Aging Mech Dis. 2018 Nov 8:4:10.
32. Xing S et al. Nicotinamide phosphoribosyl transferase related signalling pathway in early Alzheimer’s disease mouse models. Mol Med Rep. 2019 Dec;20(6):5163-5171.
33.Hosseini L et al. Nicotinamide mononucleotide and melatonin alleviate aging-induced cognitive impairment via modulation of mitochondrial function and apoptosis in the prefrontal cortex and hippocampus. Neuroscience. 2019 Dec 15:423:29-37.
34. Evandro F et al. NAD+ augmentation restores mitophagy and limits accelerated aging in Werner syndrome. Nat Commun. 2019 Nov 21;10(1):5284.
35. Nadtochiy SM et al. Cardioprotection by nicotinamide mononucleotide (NMN): Involvement of glycolysis and acidic pH. J Mol Cell Cardiol. 2018 Aug:121:155-162.
36. Rajman L et al. Therapeutic potential of NAD-boosting molecules: the in vivo evidence. Cell Metab. 2018 Mar 6; 27(3): 529–547.
37. Mahmoud Abdellatif et al. NAD+ Metabolism in Cardiac Health, Aging, and Disease. Circulation. 2021 Nov 30;144(22):1795-1817.
38. Fang J et al. NAD+ metabolism-based immunoregulation and therapeutic potential. Cell Biosci. 2023 May 10;13(1):81.
39. Navas LE et al. NAD+ metabolism, stemness, the immune response, and cancer. Signal Transduct Target Ther. 2021 Jan 1;6(1):2.
40. Tsubota K. The first human clinical study for NMN has started in Japan. NPJ Aging Mech Dis. 2016 Oct 27:2:16021.
41. Charles Brenner. Evolution of NAD Biosynthetic Enzymes. Structure. 2005 Sep;13(9):1239-40.
42. Yoshino J et al. NAD+ intermediates: The biology and therapeutic potential of NMN and NR. Cell Metab. 2018 Mar 6; 27(3): 513–528.
43. Shin-Ichiro Imai et al. It takes two to tango: NAD+ and sirtuins in aging/longevity control. NPJ Aging Mech Dis. 2016 Aug 18:2:16017.
44. Gomes AP et al. Declining NAD(+) induces a pseudohypoxic state disrupting nuclear-mitochondrial communication during aging. Cell. 2013 Dec 19;155(7):1624-38.
45. Bonkowski MS et al. Slowing ageing by design: the rise of NAD+ and sirtuin-activating compounds. Nat Rev Mol Cell Biol. 2016 Nov; 17(11): 679–690.
46. Song Q et al. The Safety and Antiaging Effects of Nicotinamide Mononucleotide in Human Clinical Trials: An Update. Adv Nutr. 2023 Nov;14(6):1416-1435.