导言:NAD+的下降有助于驱动小鼠的心血管疾病,前体NMN可以减轻这种疾病。CD38(一种消耗NAD+的酶)的缺乏可以缓解高血压和心血管疾病相关的血管变化。补充NMN或抑制CD38可通过改善血管细胞周期停滞(衰老)来恢复心血管功能。
CD38是烟酰胺腺嘌呤二核苷酸(NAD+)降解的主要酶,NAD+是400多种关键细胞活动的辅因子,这一过程被证明有助于衰老。来自四川大学和南昌大学的研究人员发表在《信号转导与靶向治疗》(Signal Transduct Target Ther)杂志上的文章表明,CD38和相关的细胞内NAD+下降对驱动动脉粥样硬化和高血压等年龄相关的心血管疾病的过程至关重要。
在缺乏CD38或补充了CD38抑制剂或NAD+前体烟酰胺单核苷酸(NMN)的小鼠中,研究人员通过限制高血压和增加血管细胞衰老(细胞不能再复制的永久状态)来阻止心血管疾病的发展。此外,研究人员观察到,CD38缺乏或NAD+补充通过抑制细胞外囊泡之间的信号传导有效载荷显著减轻了血管细胞的衰老,这些信号有效载荷促进了邻近未受损细胞的衰老。
研究人员提出:“ ‘NAD支持’疗法和CD38抑制剂的应用可能是治疗年龄相关疾病的新策略。”
衰老引发心血管疾病
心血管疾病的发病率随着年龄的增长而显著增加。衰老细胞的积累—一种永久性细胞周期停滞的状态—是衰老的标志,已被证明与心血管疾病的病理进展有关,包括心力衰竭、动脉粥样硬化性疾病和高血压。血管平滑肌细胞(VSMCs)的衰老导致病理性血管重塑和高血压控制的恶化。
NAD+的下降导致血管细胞衰老
该研究表明,从基因上去除CD38或用抑制剂阻断CD38显著减轻了化学诱导的小鼠血管重塑,这是一种心血管疾病发展的模型。当研究人员从小鼠基因删除CD38时,这些动物在驱动心血管疾病的过程中有所改善,如高血压、血管壁厚度增加(表明血管变硬、功能较弱),以及对维持血管完整性至关重要的蛋白质水平改变。
他们的结果还表明,CD38缺乏显著减轻了化学诱导的DNA损伤,并减少了这些小鼠动脉中VSMCs中衰老相关标志物的积累。
研究人员总结道:“在目前的研究中,我们证明CD38不仅有助于高血压患者的血管重塑,而且在VSMC衰老中起着有害的促衰老作用,进一步证实了NAD下降与衰老的相关性。”
提高NAD+水平可缓解高血压和血管重塑
研究人员还研究了补充NAD+是否可以挽救VSMC衰老。在健康条件下,与未修饰的小鼠相比,缺乏CD38的小鼠的整个主动脉组织的细胞内NAD+水平增加了近50%。此外,口服NMN(300mg/kg)提高NAD+水平减轻了化学诱导的高血压。在这些高血压小鼠中,注射NMN(i.p.,10 mg/kg/剂量)后,血管介质厚度、介质-管腔比和胶原沉积分别减少26%、27%和30%。
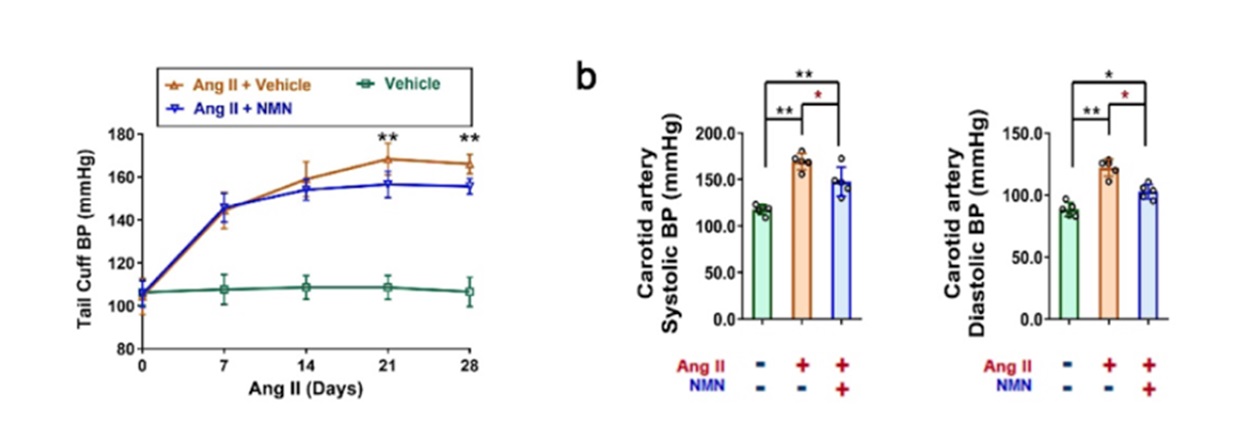
图1. NMN减轻小鼠的高血压和血管重塑。(a)注射血管紧张素II (Ang II)后,每7天检测一次NMN给药或不给药小鼠的尾动脉血压。(b)输注Ang II后4周,检测NMN给药或不给药小鼠的颈动脉收缩压和舒张压。
在细胞培养中,研究人员预先给予外源性NAD+(100μM)作用于VSMCs,并检测Ang II诱导的细胞衰老指标。结果表明,衰老细胞的阳性面积减少了54%。此外,当研究人员增加CD38水平时,VSMCs的衰老水平显著增加。这些结果有力地支持CD38可能是抗衰老治疗的潜在药理靶点。
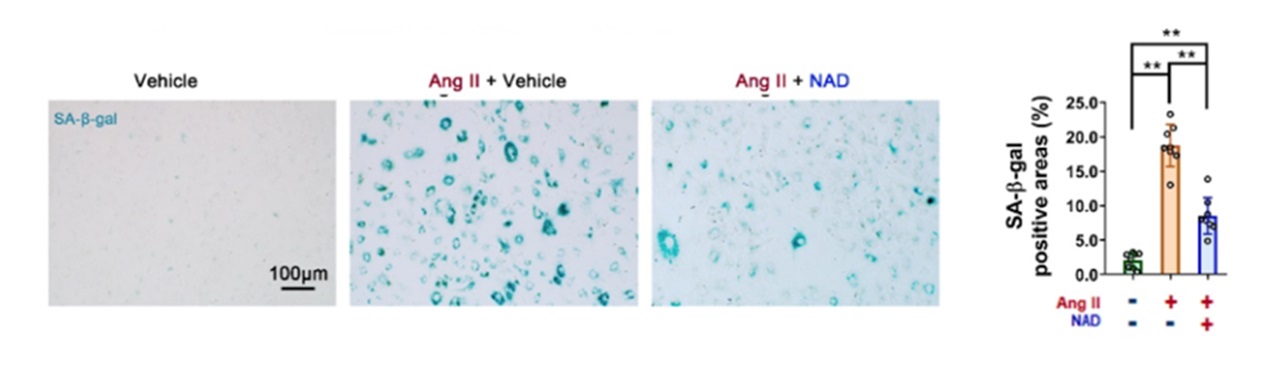
图2. 补充NAD+恢复了血管平滑肌细胞中Ang II诱导的细胞衰老。将NAD+ (100 μM)加入血管平滑肌细胞(VSMCs)培养液中4小时后再给药。这些化合物均在培养基中保存3天。然后用衰老标志物SA-β-gal对VSMCs进行染色。
CD38和NAD+控制诱导衰老的细胞间结构容器
研究人员证明,CD38缺乏通过抑制细胞外囊泡的产生、分泌和内化来减少VSMC的衰老,细胞外囊泡是由包裹细胞的相同脂肪构成的球形容器。这些结构可以在细胞和器官之间传递分子,包括在衰老过程中促进邻近细胞衰老的分子。
在这项研究中,来自Ang II攻击的平滑肌细胞的细胞外囊泡加速了邻近未受损细胞的衰老。此外,这些细胞外囊泡很容易被衰老细胞内化,加剧了这些细胞的衰老过程。
作者总结道:“因此,这些结果促进了我们对高血压患者血管平滑肌细胞衰老机制的理解,并为减少血管衰老的新治疗靶点提供了见解。”。“我们的研究结果提供了强有力的证据,表明CD38抑制或补充NAD可能是治疗年龄相关疾病的潜在策略。”
来源:本网编辑 2024.04.09.
参考文献:
Gan L et al. CD38 deficiency alleviates Ang
II-induced vascular remodeling by inhibiting small extracellular
vesicle-mediated vascular smooth muscle cell senescence in mice. Signal
Transduct Target Ther. 2021 Jun 11;6(1):223.