导言:研究数据证实,NMN给药可改善脑血管扩张(血管舒张)和血液流向大脑。
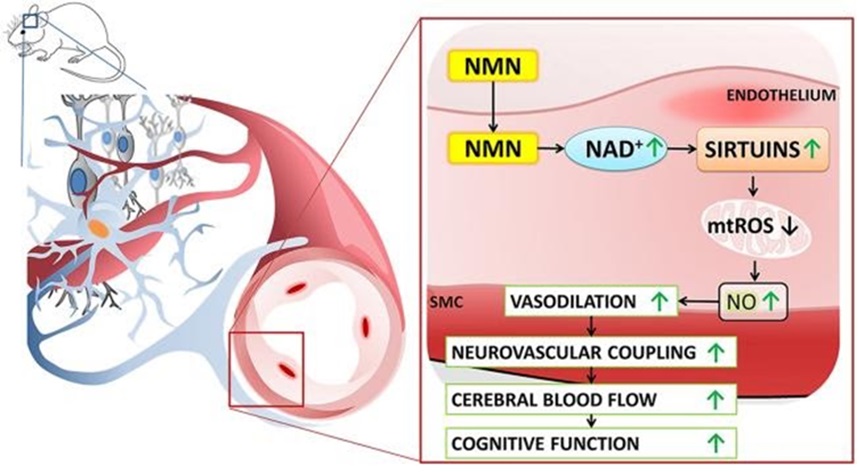
图示. NMN改善脑血管功能(Tarantini等,2019)
俄克拉荷马大学健康科学中心的科学家进行了一项研究,提供了烟酰胺单核苷酸(NMN)给药改善老年小鼠大脑功能的证据。数据表明,NMN给药可以改善脑血管扩张(血管舒张)和脑血流量,改善认知功能。
该研究人员发现,NMN补充剂可以改善老年小鼠的大脑功能。补充NMN可以改善神经血管耦合(Neurovascular coupling),这是一个当神经活动增加时,流向大脑的血液增加的过程。神经-血管耦合的改善反过来又改善了流向大脑的血液流动,这与增强大脑认知功能有关。
平衡的大脑功能(大脑稳态)需要充足的营养和氧气供应,同时清除代谢产物1,2。如果没有畅通无阻的脑血流量,大脑的平衡功能就无法实现,因为大脑血流量占总心输出量的15%3。即使人脑占身体质量的2%,它却消耗了静息体总氧气(O2)的20%2。因此,如果大脑血流减少,大脑只能在短时间内保持平衡2,4。剧烈的大脑活动需要快速调整向大脑输送的氧气和葡萄糖,以适应脑血流向大脑活动区域的增加2。6这种神经血管耦合过程是通过释放一氧化氮(NO)来实现的,NO是一种血管扩张剂,对大脑活动增加做出反应1,2。
科学家们现在越来越认识到血管(脉管系统)在老年人和老年人认知障碍和痴呆症中的关键作用1,2。越来越多的证据表明老年人的神经血管偶联反应受损2,3,5,6。科学家们还观察到老年实验动物的神经血管耦合反应受损4,7。神经血管偶联响应随年龄的增长而受损,很可能导致人类和实验动物与年龄相关的皮层功能和认知能力下降2,8。
在目前的研究中,来自俄克拉何马大学的科学家们测试了NMN补充剂通过改善线粒体(细胞的动力)的功能来恢复老年小鼠神经血管耦合反应的提议(假设)。科学家们提出(假设)补充NMN后,大脑功能(认知)将得到改善,神经血管耦合更好。在这项研究中,科学家们用NMN治疗老年小鼠2周。对小鼠进行脑血流量测试,将接受NMN治疗的老年小鼠与未接受NMN治疗的老年小鼠和年轻小鼠进行比较。这项研究的科学家随后测量了神经元中线粒体的功能,以检查NMN补充是否恢复了它们的功能。科学家们对这些老鼠进行行为评估,以确定它们的认知功能和运动协调能力。这两个过程都对神经血管偶联反应的改变很敏感。
这项研究的结果表明,在老年小鼠中补充NMN可以恢复神经血管耦合反应和脑血流量。科学家们提供了进一步的证据,证明大脑血流量的恢复来自衰老小鼠体内NO信号的增强。该研究的作者发现,补充NMN会减少线粒体中毒素(活性氧)的产生。在线粒体中,NO的产生增加;并且能量分子(ATP)的产生增加。因此,有证据表明,补充NMN可以改善老年小鼠的线粒体功能和神经血管耦合。
结果表明,补充NMN也能改善老年小鼠的认知功能。这些结果来自对补充NMN的年轻小鼠、老年小鼠和老年小鼠组进行的实验测试。科学家们对所有三组进行水迷宫任务,以测量学习和记忆表现。研究小组发现,幼鼠的学习能力和记忆力最好。学习和记忆最差的是老年小鼠,而与老年小鼠组相比,补充NMN的老年小鼠的学习和记忆显著改善。科学家们在研究中进行了其他测试,包括一项名为“提升+迷宫”的迷宫任务,这提供了证据,证明补充NMN可以提高老年小鼠在需要学习和记忆的任务中的表现,以及运动技能。
科学家们建议用烟酰胺腺嘌呤二核苷酸(NAD+)前体NMN治疗老年小鼠,可以恢复神经血管偶联反应。神经-血管耦合反应的恢复反过来又改善了老年小鼠的高级大脑功能。研究中的老年小鼠有许多方面的脑血管功能障碍(脑微血管系统)和认知能力下降,也表现在老年患者身上。正如科学家们所说,“……我们的研究结果表明,补充NMN对老年小鼠具有显著的脑组织血管保护作用。NMN治疗可以减轻内皮氧化应激,改善内皮功能,挽救老年皮层的NVC反应,这可能有助于改善高级皮层功能。
来源:本网编辑 2024.04.10.
主要参考文献:
Tarantini S et al. Nicotinamide mononucleotide (NMN) supplementation rescues cerebromicrovascular endothelial function and neurovascular coupling responses and improves cognitive function inn aged mice. Redox Biol. 2019 Jun:24:101192.
其他参考文献:
1. Kiss T et al. Nicotinamide
mononucleotide (NMN) supplementation promotes neurovascular rejuvenation in
aged mice: transcriptional footprint of SIRT1 activation, mitochondrial
protection, anti-inflammatory, and anti-apoptotic effects. Geroscience.2020;42(2):527-546.
2. Tarantini S et al. Impaired
neurovascular coupling in aging and Alzheimer’s disease: Contribution of
astrocyte dysfunction and endothelial impairment to cognitive decline. Exp
Gerontol, 2017 Aug:94:52-58.
3. Topcuoglu MA et al. Occipital
cortex activation studied with simultaneous recordings of functional
transcranial Doppler ultrasound (fTCD) and visual evoked potential (VEP) in
cognitively normal human subjects: Effect of healthy aging. Neurosci
Lett, 2009; 452(1): 17-22.
4. Stefanova I et al. Age-related
changes of blood-oxygen-level-dependent signal dynamics during optokinetic
stimulation. Neurobiol Aging, 2013 Oct;34(10):2277-86.
5. Zaletel M et al. Age-related
changes in the relationship between visual evoked potentials and visually
evoked cerebral blood flow velocity responses. Funct Neurol, 2005;
20(3): 115-20.
5. Fabiani M et al. Neurovascular
coupling in normal aging: A combined optical, ERP and fMRI study. Neuroimage,
2014 Jan 15;85 Pt 1(0 1):592-607.
6. Toth P et al. Functional
vascular contributions to cognitive impairment and dementia: mechanisms and
consequences of cerebral autoregulatory dysfunction, endothelial impairment,
and neurovascular uncoupling in aging. Am J Physiol Heart Circ
Physiol. 2017 Jan 1;312(1):H1-H20.
7. Park L et al. Nox2-Derived
Reactive Oxygen Species Mediate Neurovascular Dysregulation in the Aging Mouse
Brain. J Cereb Blood Flow Metab, 2007; 27(12): 1908-18.
8. Farzaneh A et al. Neurovascular
coupling, cerebral white matter integrity, and response to cocoa in older
people. Neurology. 2013 Sep 3;81(10):904-9.