导言:澳洲科学家和哈佛大学学DA辛克莱的联合研究证明,升高NAD+水平可能提供一种有效和非侵入性的策略,恢复和维持在衰老过程中的雌性生育能力。科学家们在实验中使用NAD+前体烟酰胺单核苷酸(NMN)来恢复雌性小鼠的NAD+水平。
发展中国家普遍存在一种趋势,即由于社会经济原因,人们推迟怀孕1,2。与年龄相关的怀孕障碍与人们等待更长时间怀孕相冲突2,3,12。这种情况导致对不孕不育治疗(包括体外受精)的需求增加。而采用体外受精有许多缺点,因为这种手术具有侵入性,存在健康风险2,6,费用高昂,成功率有限2。反复的体外受精失败会带来情绪压力,而怀孕失败也会导致关系破裂2,5。
在体外受精中,限制成功的因素是女性未成熟卵细胞(卵母细胞)的数量和质量,当女性达到30多岁时,这些卵母细胞开始下降2,3,12。尽管非常需要一种非侵入性的治疗方法,但目前还没有通过年龄增长来恢复或保持卵母细胞数量或质量的策略2。这种治疗可以在没有医疗干预的情况下增加受孕的机会,或者减少限制体外受精成功因素的影响2。
与年龄相关的卵母细胞质量下降有关的分子机制尚不清楚。被认为起关键作用的因素包括染色体不稳定(基因组不稳定)、细胞代谢减少(线粒体生物能量学减少)、细胞中氧化应激增加(活性氧增加)以及卵细胞产生过程中染色体分离受损(减数分裂)。随着母亲年龄的增加,减数分裂期间染色体分离受损导致胚胎中染色体数量异常(非整倍体)。这导致出生时染色体异常的儿童发病率增加,包括导致21-三体综合征(唐氏综合症)2,13。母亲年龄增加导致染色体分离异常的原因尚不清楚。目前没有药物干预措施来纠正这一问题。对这种现象的分子基础的理解可能会产生治疗方法,从而提高女性在衰老过程中的生育能力。
这项研究的作者想检验补充NAD+水平是否能改善女性与年龄相关的生育能力下降。科学家们还研究了一种消耗NAD+的酶SIRT2在卵母细胞质量和胚胎发育中的作用。科学家们检查了NAD+和消耗它的酶,因为这种必需辅酶在身体其他组织(体细胞组织)中的水平随着年龄的增长而下降2,8。通过补充NAD+前体来逆转NAD+水平的下降,作为一种在晚年保持健康的疾病治疗策略,已经引起了人们的关注2,9,10。科学家们想研究补充NAD+生物合成前体NMN是否能改善卵母细胞的完整性,从而提高女性在衰老过程中的生育能力。
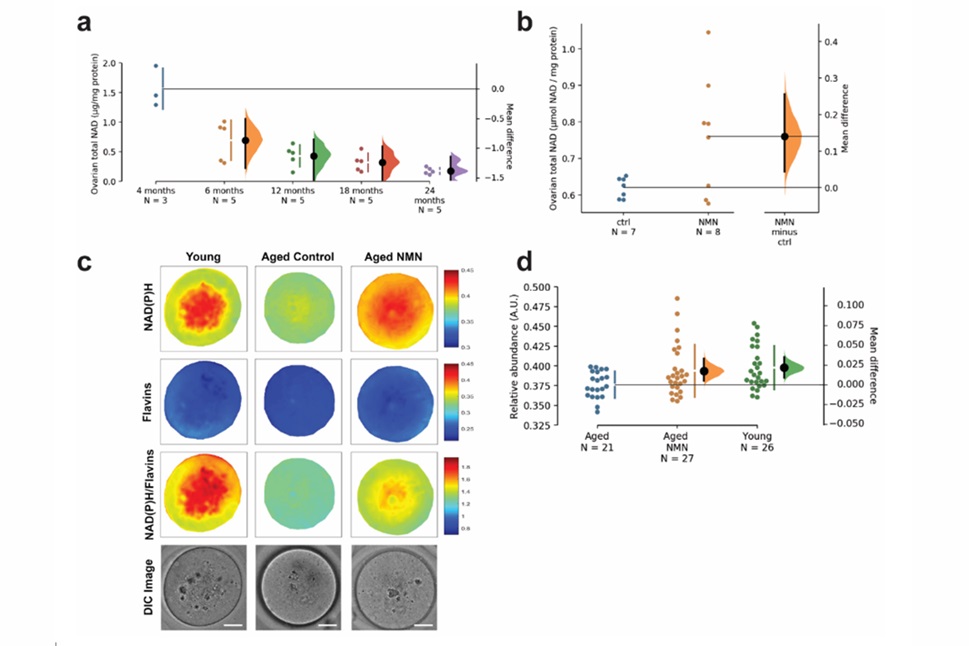
图1. 显示卵巢中NAD+水平随着年龄的增长而下降;显示了在“c”中用NMN处理的衰老卵母细胞中NAD(P)H水平的增加,并量化了在“d”中增加的NAD(P)H水平
科学家们发现有证据表明,补充NMN可能是一种策略,可以部分补充与年龄相关的卵巢NAD+水平下降。为了解决补充NAD+水平对生育能力的影响,科学家们对小鼠进行了研究。他们首先想弄清楚生殖组织中的NAD+水平是否会随着年龄的增长而下降。如果是这样,科学家们试图了解这是否会导致不孕不育和随着年龄的增长而减少卵母细胞完整性。小鼠的生育能力在8个月大左右开始下降。生育能力下降的原因是卵母细胞缺陷,这些缺陷与人类有很多相似之处2,4。在正常(野生型)小鼠的卵巢中,NAD+水平从四个月大开始急剧下降(见图“a”)。研究人员用NMN治疗10个月大的小鼠,它显著提高卵巢中的NAD+水平。
科学家们发现,与幼龄动物相比,12个月大的衰老动物的卵母细胞中NAD+丰度标志物NAD(P)H的水平正在下降。研究小组发现,老年动物口服NMN可增加NAD(P)H水平(见上图)。科学家们试图确定,除了卵巢外,卵母细胞(即未成熟的卵子)中的NAD+水平是否会随着年龄的增长而降低。如果是这样,该小组将检查口服NMN治疗是否可以逆转NAD+水平的下降。利用一种称为自体荧光高光谱成像的技术,该小组检查了从12个月大的雌性中提取的卵母细胞。科学家们用妊娠母马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)处理过的雌性生殖道中提取卵母细胞。
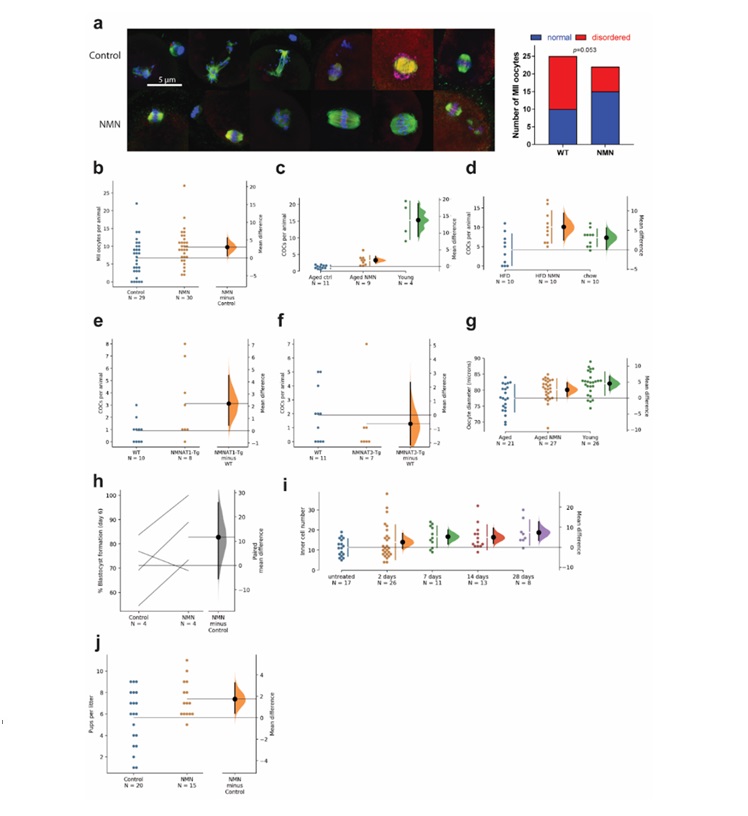
图2. 接受(上图)和未接受(下图)NMN治疗的14个月大老年雌性的染色体结构有所改善。右图显示,与未经NMN治疗的老年雌性相比,经NMN处理的老年雌性的正常卵母细胞比例有所提高。
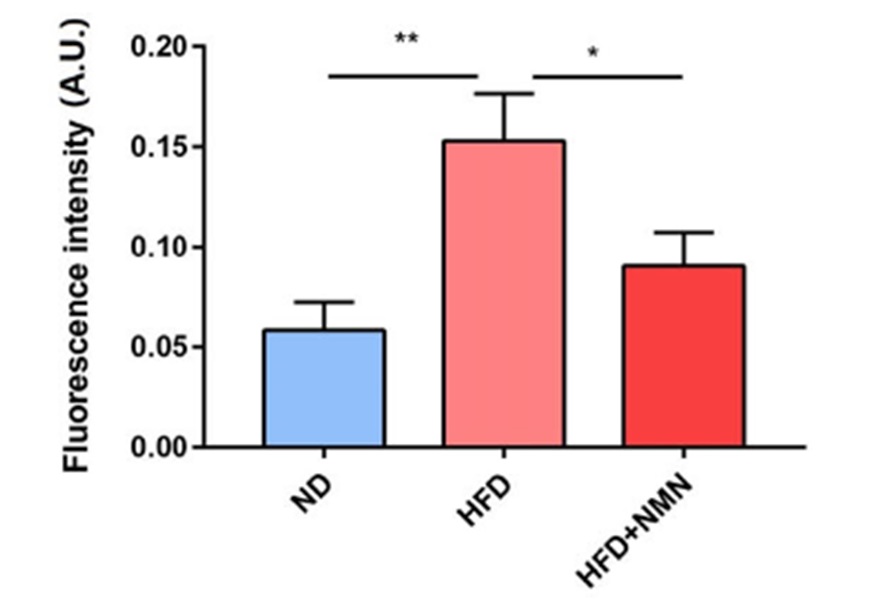
然后,科学家们发现,与未经NMN治疗的14个月大雌性相比,对14个月龄雌性进行NMN治疗可以改善卵母细胞的完整性。科学家们用饮用水中的NMN(2g/L)对14个月大的雌性进行为期四周的治疗。科学家们从这些动物的卵巢中收集卵母细胞,并使用一种名为“免疫染色”的实验室技术对卵母细胞进行成像。科学家们观察染色体结构(纺锤体结构)和染色体排列(见图“a”)。与未接受NMN治疗的雌性相比,接受NMN处理的老年雌性显示“正常”染色体完整性的卵母细胞比例显著提高。科学家们还从这项实验中获得了数据,表明NMN可以增加肥胖动物五到六个月高脂肪饮食的卵母细胞产量;肥胖是一种生理挑战,导致不孕2,11和NAD+水平降低2,14。
研究产生的数据表明,NMN可以提高体外受精卵母细胞的质量。内部细胞质量高度预测植入和妊娠的成功2,7。研究使用12个月大的小鼠在饮用水中摄入NMN 2、7、14或28天,然后提取卵母细胞。科学家们收集卵母细胞(MII卵母细胞)并进行体外受精。在第六天,研究人员使用一种名为“染色”的方法在显微镜下检查内部细胞质量。结果表明,NMN处理后细胞内部质量大小有所改善。随着对动物进行更长时间的NMN治疗,科学家们也观察到了更显著的改善。
然后,研究发现了支持NAD+增强老年雌性小鼠生育能力的证据。研究从10周大开始用NMN(2g/L的饮用水)治疗小鼠。在18周大时,该小组引入一只已证明具有生育能力的雄性进行交配。研究每七到八周重复一次这个过程,直到50周。在50周大的时候,研究人员记录下每窝出生的活幼崽的数量。先前的实验也表明,NMN处理增加了动物的产仔数。
这组研究发现,母亲接触NMN的后代发育正常。数据确实表明,母亲接受NMN治疗的后代的瘦体重有小幅但持续的改善。正如科学家们所说,“这种变化的原因尚不清楚,值得进一步调查。”2
科学家们继续获取数据,表明当SIRT2(一种NAD+依赖性的sirtuin)表达增加时,它可以在衰老过程中为卵母细胞的完整性提供益处。研究人员使用SIRT2表达增加的小鼠(SirtTg/+转基因小鼠),该小鼠在包括卵母细胞在内的所有组织中都过表达SIRT2。在14个月大时,科学家们评估卵母细胞的质量。在正常小鼠(野生型)中,来自老年动物的大约70%的卵母细胞具有紊乱和排列不良的染色体。在过表达SIRT2的小鼠中,80%的卵母细胞表现出正常、排列良好的染色体。在过表达SIRT2的老年小鼠中,显示染色体数量异常(非整倍体)的卵母细胞百分比与年轻雌性卵母细胞相当,尽管非整倍率通常随着年龄的增长而增加。
为了研究SIRT2是否对生育能力是必要的,科学家们使用了不表达SIRT2的小鼠(SIRT2-/-敲除动物)。未表达SIRT2的年轻小鼠在显微镜下显示正常染色体。正如作者所说,“……在NAD充足的较年轻年龄,SIRT2对准确的纺锤体组装并不重要,或者SIRT2的作用与其他尚未确定的因素存在冗余。”2 作者接着说,“综合这些数据表明,SIRT2是足够的,但在衰老过程中提高卵母细胞质量不是必需的。”2
科学家们提供的数据表明,添加NMN可以提高早期胚胎(囊胚)的细胞数量,这表明体外受精后的植入成功。科学家们使用12个月大和4周大雌性的成熟卵母细胞进行体外受精。与不使用NMN生长的老年雌性胚胎相比,使用NMN从老年雌性生长(培养)的胚胎具有改善的早期胚胎(囊胚)形成。科学家们在年轻雌性胚胎中观察到,NMN处理和不处理的胚胎之间没有差异。
这篇文章的作者证明,增加老年雌性小鼠体内NAD+水平可以部分恢复生育能力。科学家们使用NMN补充剂来恢复NAD+水平。这些数据提供了有趣的发现,因为发达社会的人们继续推迟怀孕。由于人们推迟受孕,与年龄相关的障碍会阻碍怀孕。寻找一种药物方法来保持老年女性一定程度的生育能力,为受孕提供了一种非体外受精的选择,因为情绪混乱和关系破裂与体外受精失败有关。药物治疗也可以提高体外受精过程中胚胎存活的机会。
来源:本网编辑 2024.04.22.
主要参考文献:
Bertoldo MJ et al. NAD+ repletion rescues female fertility during reproductive ageing. Cell Rep. 2020 Feb11;30(6):1670-1681.e7.
其他参考文献:
1. Adamson GD et al. International Committee for Monitoring Assisted Reproductive Technology: world report on assisted reproductive technology, 2011. Fertil Steril, 2018 Nov;110(6):1067-1080.
2. Bertoldo MJ et al. NAD+ repletion rescues female fertility during reproductive ageing. Cell Rep. 2020 Feb11;30(6):1670-1681.e7.
3. Michel De Vos et al. Fertility preservation in women with cancer. Lancet.2014 Oct 4;384(9950):1302-10.
4. Greaney J et al. Regulation of chromosome segregation in oocytes and the cellular basis for female meiotic errors. Hum Reprod Update. 2018 Mar 1;24(2):135-161.
5. Kjaer T et al. Divorce or end of cohabitation among Danish women evaluated for fertility problems. Acta Obstet Gynecol Scand. 2014 Mar;93(3):269-76.
6. Kumar P et al. Ovarian hyperstimulation syndrome. J Hum Reprod Sci. 2011 May;4(2):70-5.
7. Lane M et al. Differential regulation of mouse embryo development and viability by amino acids. J Reprod Fertil. 1997 Jan;109(1):153-64
8. Massudi H et al. Age-associated changes in oxidative stress and NAD+ metabolism in human tissue. PLoS One. 2012;7(7):e42357.
9. Mills KF et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 2016 Dec 13;24(6):795-806.
10. Rajman L et al. Therapeutic potential of NAD-boosting molecules: the in vivo evidence. Cell Metab. 2018 Mar 6;27(3):529-547.
11. Rittenberg V et al. Effect of body mass index on IVF treatment outcome: an updated systematic review and meta-analysis. Reprod Biomed Online. 2011 Oct;23(4):421-39.
12. Mark V Sauer. Reproduction at an advanced maternal age and maternal health. Fertil Steri 2015 May;103(5):1136-43.
13. R J Snijders et al. Maternal age- and gestation-specific risk for trisomy 21. Ultrasound Obstet Gynecol. 1999 Mar;13(3):167-70.
14. Yoshino J et al. Nicotinamide mononucleotide, a key NAD+ intermediate, treats the pathophysiology of diet- and age-induced diabetes in mice. Cell Metab. 2011 Oct 5;14(4):528-36.