NAD+是什么?它对健康和长寿很重要吗?
随着老龄化社会到来,NAD+成为科学界和大众关注健康的最热门话题之一。NAD+是什么?为什么它会随着年龄增长而快速下降?提高NAD+水平真的能健康长寿吗?它在细胞内是如何合成的?NAD+有哪些潜在益处?
目录:
1.NAD+作用机制
2.1.细胞如何合成NAD+
2.2.NAD+分子组成
2.3.补充NAD+合成前体有用吗?
2.4.NAD+水平降低带来的影响
3.NAD+潜在益处
3.1.NAD+与衰老
3.2.NAD+与肌肉功能
3.3.NAD+与代谢紊乱
3.4.NAD+与心脏功能
3.5.NAD+与神经变性
4.NAD+延寿作用
5.1.健康饮食
5.2.活动身体
5.3.避免有害的阳光
5.4.寻找热源
5.5.补充NAD+前体
7.参考文献
从细菌等单细胞生物到灵长类等复杂的多细胞生物,NAD+(烟酰胺腺嘌呤二核苷酸)是最丰富和最关键的分子之一。如果没有NAD+,人体等生物体将走上死亡的快车道。这种分子是细胞能量生成功能(线粒体)的关键1。NAD+不仅有助于将食物转化为能量,而且在保持DNA完整性2和确保适当的细胞功能以保护有机体免受衰老和疾病的影响方面发挥着至关重要的作用。
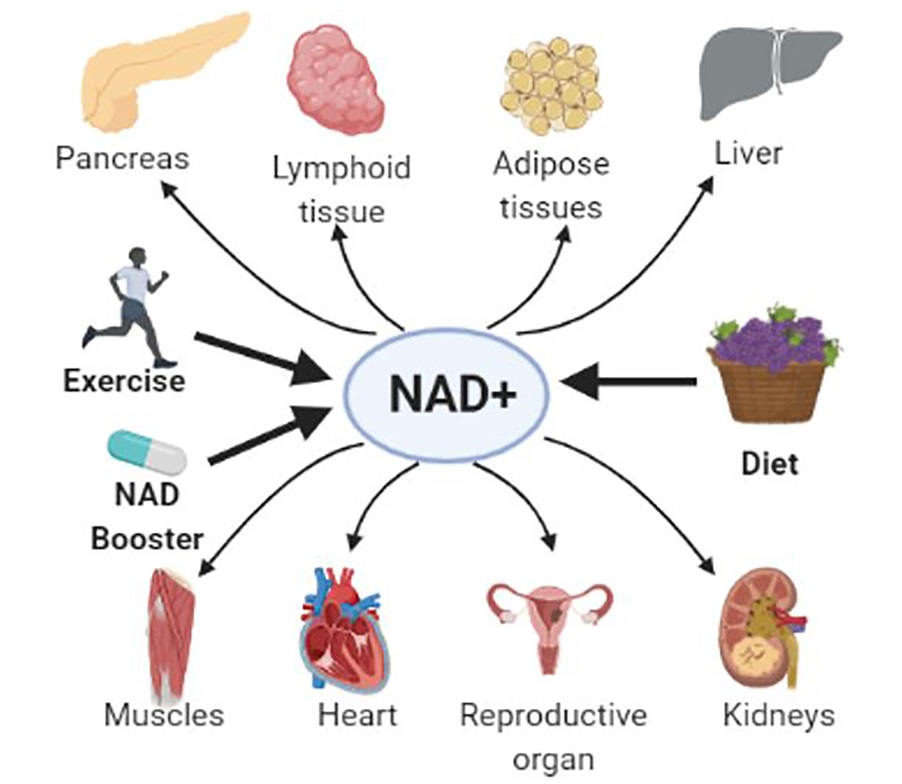
图1. NAD+与系统性健康状况有关(图源:互联网)
NAD+就像一辆穿梭巴士,在细胞内将电子从一个分子转移到另一个分子,以进行各种反应和过程。这种重要分子与其分子对应物NADH一起参与产生细胞能量的各种代谢反应3。如果没有足够的NAD+水平,我们的细胞将无法产生任何能量来生存和发挥其功能。NAD+的其他功能包括调节昼夜节律,控制我们身体的睡眠/觉醒周期4。
NAD+水平随着年龄的增长而下降
随着年龄的增长,NAD+水平下降,可能每20年下降约50%5。这表明其在代谢功能和年龄相关疾病中具有重要意义。DNA损伤随着年龄的增长而积累,其势如滚雪球一样。
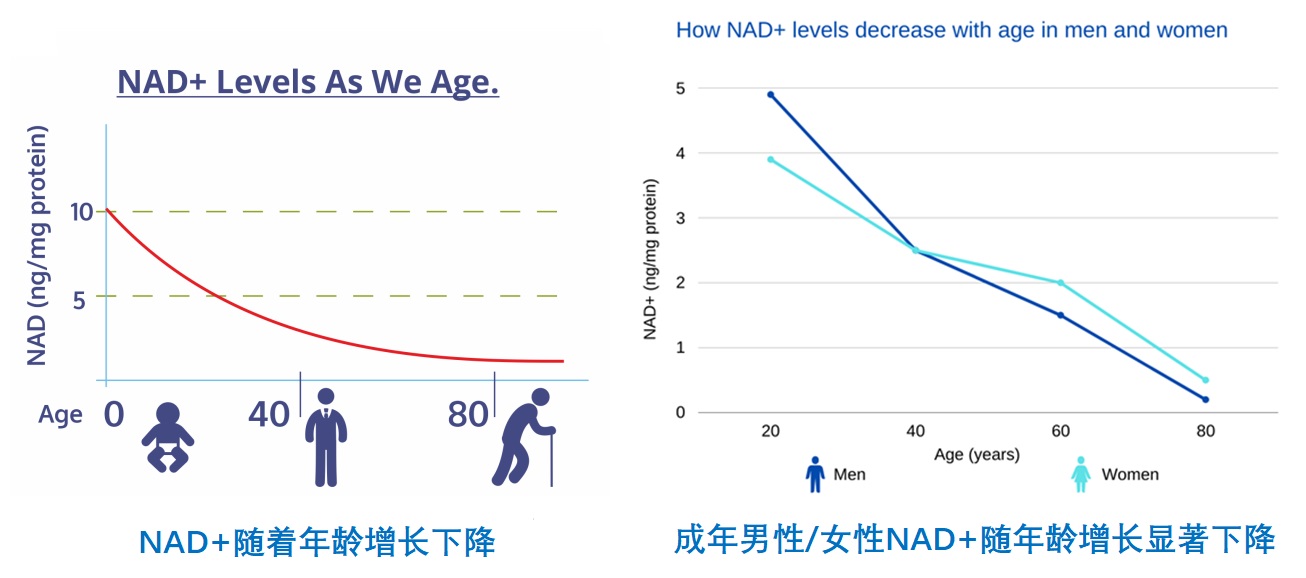
图2. 体内NAD+水平随着年龄增长快速下降(图源:互联网)
对我们基因蓝图的破坏激活了几种蛋白质,包括被称为PARP的酶6。通过消耗NAD+,PARP可以执行DNA修复功能7。衰老过程中通过PARP激活的NAD+耗竭似乎会导致各种疾病。在所有这些需要NAD+的功能中,许多科学家认为PARP的作用最大。
我们免疫系统中的酶也消耗NAD+。免疫系统越活跃,酶消耗的NAD+就越多。随着年龄的增长,我们免疫系统中的酶水平会增加,从而耗尽体内的NAD+水平8。
另一类使用NAD+的酶被称为Sirtuins。这些蛋白质与健康衰老和寿命有关,它们利用NAD+调节新陈代谢,维持染色体稳定,以及修复受损的DNA等9。由于DNA损伤和染色体不稳定性随着年龄的增长而积累,Sirtuins会消耗更多的NAD+。
2.1.细胞如何合成NAD+
细胞产生分子的过程被称为“生物合成”。对于NAD+,有三种已知途径:从头(de novo)途径、普瑞斯-汉德勒(Preiss-Handler)途径和挽救途径(Salvage pathway)9,10。
de novo途径启动色氨酸,沿着这些路线,来自肉类、奶酪、鸡蛋和鱼类等食物的色氨酸被转化为NAD+,它发生在细胞的胞质溶胶(位于细胞细胞器之外)中。
Preiss-Handler途径始于烟酸(维生素B3的常见形式)。通常,烟酸存在于食物中,但也可以通过膳食补充剂摄入。这种NAD+前体分子也由肠道或唾液中的细菌菌群产生。烟酸通过三个步骤转化为NAD+。在第一步中,NAPRT酶将烟酸转化为烟酸单核苷酸(NAMN)。在第二步中,NMNAT酶将NAMN转化为烟酸腺嘌呤二核苷酸(NAAD)。NAD+合成酶(NADS)将NAAD转化为NAD+。
NAD+生物合成的挽救途径使用与维生素B3相关的天然存在的化合物。这些化合物包括烟酰胺(NAM)、烟酸(NA)、烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)。挽救途径中的NAD+生物合成涉及烟酰胺通过磷酸核糖基转移酶NMNAT转化为NMN。该酶将NMN转化为NAD+。NR在酶NRK的作用下转化为NMN。NMN通过NMNAT的酶活性转化为NAD+。
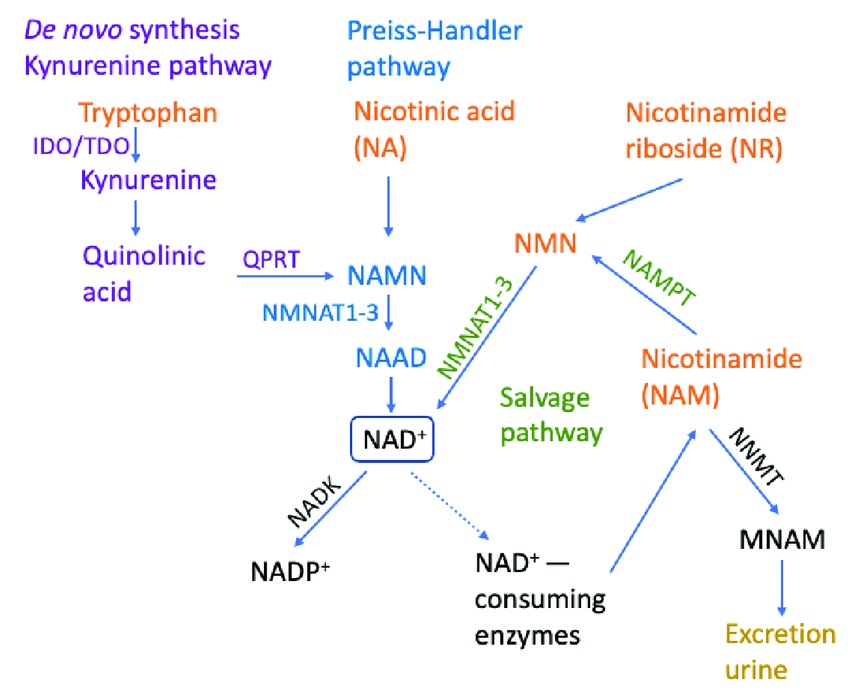
图3. NAD+细胞合成途径(图源:互联网)
2.2.NAD+分子组成
NAD+由二个通过磷酸基团连接的核苷酸组成。一个核苷酸含有腺嘌呤碱基,另一个含有烟酰胺。如图4。
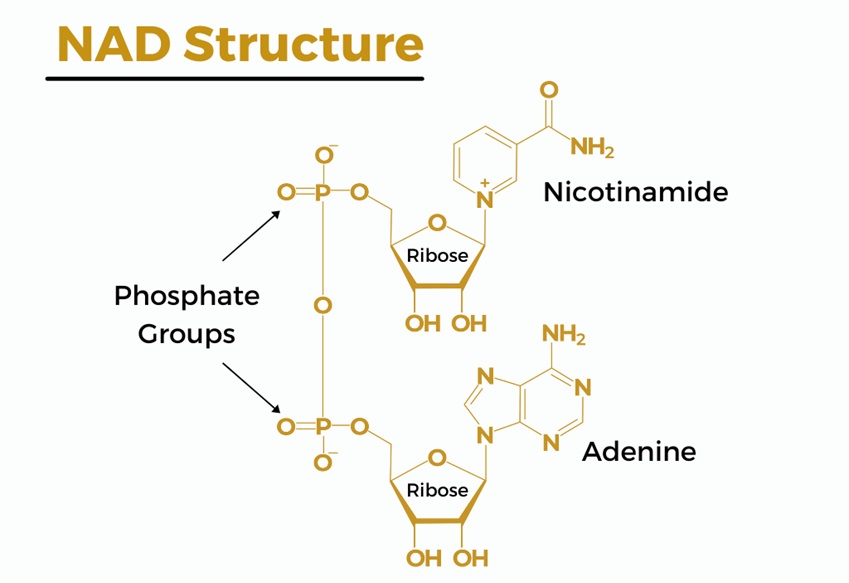
图4. NAD+分子组成(图源:互联网)
2.3.补充NAD+合成前体有用吗?
补充NAD+前体是一种潜在的治疗策略,可以减缓衰老并改善与年龄相关的疾病的状况7。口服补充NAD+尚未证明对提高体内NAD+水平有任何益处11。然而,补充前体物如NMN或NR,可能会提供这些益处。
研究表明,补充NMN可以预防各种疾病。这种作用可能是通过增加体内NAD+水平而产生的。补充NMN可以减少小鼠的肥胖,保护血管免受损伤12。这种益处来自老年痴呆(阿尔茨海默病)、认知障碍和神经炎症的小鼠疾病模型13。用NR补充小鼠也具有类似的有益效果。
老鼠身上的这些有益效果能应用于人类吗?只有在人类身上进行的临床试验才能证明这一点。哪种前体补充剂在衰老过程中促进体内NAD+水平升高,NMN还是NR?科学家之间的争论仍在继续。
2.4.NAD+水平降低带来的影响
大量研究表明,在营养紊乱的情况下,如肥胖和衰老,NAD+水平会降低。NAD+水平的降低可导致新陈代谢问题,因而导致多种疾病,包括肥胖和代谢综合征(或胰岛素抵抗)14;肥胖会导致糖尿病和高血压。
由低NAD+水平引起的代谢紊乱级联式下降15。高血压和其他心脏功能下降会向大脑发送破坏性的压力波,可能导致认知障碍16。
针对NAD+代谢是一种实用的营养干预措施,可预防代谢和其他与年龄相关的疾病。几个小组已经进行了研究,表明补充NAD+加强剂可以改善肥胖引起的胰岛素抵抗。在年龄相关疾病的小鼠模型中,补充NAD+加强剂可以改善疾病症状。这表明,随着年龄的增长,NAD+水平的降低可能导致与年龄相关的疾病发生。
防止NAD+的减少为对抗随着年龄增长而出现的代谢紊乱提供了一种很有前途的策略。由于NAD+水平随着年龄的增长而降低,这可能导致DNA修复、细胞应激反应和能量代谢调节减少。
NAD+对物种的线粒体维持和衰老相关的基因调控很重要。然而,随着年龄的增长,我们体内的NAD+水平急剧下降。哈佛大学的David Sinclair在接受采访时表示:“随着年龄的增长,我们会失去NAD+。到50岁时,NAD+水平大约是20岁时的一半。”。
研究表明,NAD+的减少与年龄相关的疾病有关,包括加速衰老、代谢紊乱、心脏病和神经退行性变。低水平的NAD+与年龄相关的疾病有关,因为功能代谢较少。但补充NAD+水平在动物模型中具有抗衰老作用,在逆转与年龄相关的疾病、延长寿命和健康寿命方面显示出有希望的结果。
3.1.NAD+与衰老
Sirtuins被称为“基因组的守护者”,是保护从植物到哺乳动物的生物体免受退化和疾病影响的基因。当基因感觉到身体处于身体压力下,如锻炼或饥饿时,它会派出护卫者来保护身体。Sirtuins维持基因组完整性,促进DNA修复,并在模型动物中显示出与衰老相关的特性,如延长寿命。
NAD+是驱动基因发挥作用的燃料。但就像汽车没有燃料就无法行驶一样,Sirtuins需要NAD+17。研究结果表明,提高体内NAD+水平可以激活sirtuins,延长酵母、蠕虫和小鼠的寿命3。尽管补充NAD+在动物模型中显示出有希望的结果,但科学家们仍在研究这些结果如何转化为人类。
3.2.NAD+与肌肉功能
作为身体的动力来源,线粒体功能对我们的运动表现至关重要。NAD+是维持线粒体健康和能量输出稳定的关键之一。
增加肌肉中的NAD+水平可以改善小鼠的线粒体和体质18。其他研究还表明,服用NAD+加强剂的小鼠更瘦,可以在跑步机上跑得更远,显示出更高的运动能力19。NAD+水平较高的老年动物表现优于同类动物。
3.3.NAD+与代谢紊乱
已经被世界卫生组织(WHO)宣布为流行病,肥胖是现代社会最常见的疾病之一。肥胖会导致其他代谢紊乱,如糖尿病。2016年,糖尿病导致全球160万人死亡20。
衰老和高脂肪饮食会降低体内NAD+的水平。研究表明,服用NAD+加强剂可以缓解小鼠与饮食相关和与年龄相关的体重增加,并提高其运动能力,甚至在老年小鼠中也是如此21。其他研究甚至逆转了雌性小鼠的糖尿病效应22,显示出对抗代谢紊乱的新策略。
3.4.NAD+与心脏功能
动脉的弹性在心跳发出的压力波之间起到缓冲作用。但随着年龄的增长,动脉会变硬,导致高血压,这是心血管疾病最重要的风险因素。
高血压会导致心脏增大和动脉堵塞,从而导致中风。提高NAD+水平可以保护心脏,改善心脏功能23。在小鼠中,NAD+加强剂将心脏中的NAD+水平补充到基线水平,并防止了因缺乏血液流动而对心脏造成的损伤。其他研究表明,NAD+加强剂可以保护小鼠免受异常心脏增大的影响24。
3.5.NAD+与神经变性
根据WHO的数据,到2050年,世界60岁及以上人口预计将达到20亿,几乎是2015年的两倍25。全世界的人都活得更长了。然而,衰老是许多神经退行性疾病的主要风险因素,包括帕金森氏症和阿尔茨海默氏症,导致认知障碍。
在患有阿尔茨海默氏症的小鼠中,提高NAD+水平可以减少蛋白质的积累,而蛋白质的积累会破坏细胞通讯并增加认知功能26。当流向大脑的血液不足时,提高NAD+水平也可以保护脑细胞免于死亡。许多动物模型研究为帮助大脑健康衰老和预防神经退行性变提供了新的前景27。
用NMN或NR等加强剂增加NAD+可以延长小鼠的寿命和健康长寿。研究表明,增加NAD+水平对延长小鼠的寿命产生了适度的影响。科学家在2016年发表在《科学》(Science)杂志上的一项研究中发现,使用NAD+前体NR可使小鼠的寿命延长约5%21。
NAD+水平的提高还可以保护人体免受各种与年龄相关的疾病的侵袭。预防与年龄相关的疾病意味着更健康地生活更长的时间,增加健康寿命。
事实上,一些像D. Sinclair世界著名的抗衰老科学家认为动物研究的结果是成功的,他们自己也在服用NAD+加强剂。然而,美国国立卫生研究院(NIH)国家老龄研究所的Felipe Sierra等其他科学家认为这种药物还没有准备好。他说:“最重要的是,我不会尝试这些东西。为什么不呢?因为我不是老鼠。”。
对老鼠来说,寻找“青春之泉”的工作可能已经结束了。然而,对于人类来说,科学家们一致认为,我们还没有完全做到这一点。NMN和NR在人体中的临床试验可能在未来几年内提供结果。
NAD+水平可以通过促进其合成而自然增加—增强参与NAD+生物合成的酶或服用NAD+前体分子。
5.1.健康饮食
通过健康的饮食和适度的运动来引导健康的生活方式不仅有利于心理健康,还可以提高NAD+水平。
对身体的轻微身体压力,如禁食和锻炼,可以刺激NAD+的产生。在酵母中,热量限制(CR)激活NAD+依赖性基因Sirtuins,并显著延长其寿命。热量限制也持续改善不同品种和性别的小鼠的健康寿命。
5.2.活动身体
自然提高NAD+水平和整体健康的最简单方法之一是锻炼。经常锻炼可以增强体内的DNA重建蛋白,在保持健康体重的同时保持身体强壮。基于日常锻炼,身体会产生更多的NAD+。保持身材有助于减缓不可避免的衰老过程。
最近一项针对人类的研究发现,有氧运动和阻力运动可以恢复肌肉中参与NAD+合成的年龄依赖性酶28。许多动物研究表明,动物也可以通过运动来提高NAD+水平。
5.3.避免有害的阳光
如果在阳光下呆的时间太长,可能会降低NAD+的水平。阳光直射可能会导致身体使用大量的NAD+来修复太阳紫外线造成的损伤。
为了避免皮肤损伤,在阳光明媚的时候尽量减少户外活动的时间,并始终记得穿上轻便宽松的衣服。
5.4.寻找热源
虽然在阳光直射下对整体健康和NAD+水平不利,但在自然或人工高温下却可以帮助提高NAD水平9。
常见的热源,如桑拿浴室、热水浴缸和温水游泳池,可能会导致心跳加快,迫使身体使用更多的能量来保持凉爽。这会触发NAD+的产生增加,从而提供必要的能量。
5.5.补充NAD+前体
人们使用NMN和NR作为补充剂来提高NAD+水平。NMN和NR是NAD+的生物合成前体。这些前体之间的相似之处包括它们对NAD+生物合成的“挽救途径”的使用。这二种分子对人类消费被证明是安全的。
科学家对人体进行了研究,证明NR可以提高NAD+水平。对NMN的研究还表明,NMN能够提高啮齿动物体内的NAD+水平。
一项研究表明,小鼠的肠道中有一种NMN转运蛋白。同一转运蛋白的基因存在于人类中。如果NMN转运蛋白在人类中具有类似的表达,则身体可以利用NMN29。
人们服用NAD+补充剂的原因多种多样,包括提高运动成绩、保持肤色年轻和对抗与年龄相关的疾病等。尽管一些人声称提高NAD+水平让他们感觉年轻有活力,但其他人却没有看到同样的结果。
来自动物研究的越来越多的证据可能助长了对这些治疗主张的炒作。补充NAD+前体可提高细胞中NAD+的生物利用度,逆转与年龄相关的疾病,并适度延长动物模型的寿命。然而,问题仍然是这些动物模型的发现是否能转化为人类。目前,尚需要更多的临床试验证据支持这些补充剂对人体具有明确的治疗作用。
来源:本网编辑 2024.04.30.
1. Johnson S et al. NAD + biosynthesis, aging, and disease. F1000Res. 2018; 7: 132.
2. Etchegaray J-P et al. Interplay between metabolism and epigenetics: a nuclear adaptation to environmental changes. Mol Cell. 2016 Jun 2; 62(5): 695–711.
3. Katsyuba E et al. Modulating NAD + metabolism, from bench to bedside. EMBO J. 2017 Sep 15; 36(18): 2670–2683.
4. Nakahata Y et al. The Circadian NAD+ Metabolism: Impact on Chromatin Remodeling and Aging. Biomed Res Int. 2016:2016:3208429.
5. McReynolds MR et al. Age-related NAD+ decline. Exp Gerontol. 2020 Feb 22:134:110888.
6. Surjana D et al. Role of Nicotinamide in DNA Damage, Mutagenesis, and DNA Repair. J Nucleic Acids. 2010; 2010: 157591.
7. Braidy N et al. Role of Nicotinamide Adenine Dinucleotide and Related Precursors as Therapeutic Targets for Age-Related Degenerative Diseases: Rationale, Biochemistry, Pharmacokinetics, and Outcomes. Antioxid Redox Signal. 2019 Jan 10; 30(2): 251–294.
8. Camacho-Pereira J et al. CD38 Dictates Age-Related NAD Decline and Mitochondrial Dysfunction through an SIRT3-Dependent Mechanism. Cell Metab. 2016 Jun 14;23(6):1127-1139.
9. Rubén Zapata‐Pérez R et al. NAD+ homeostasis in health and disease. EMBO Mol Med. 2021 Jul 7; 13(7): e13943.
10. Xie N et al. NAD+ metabolism: pathophysiologic mechanisms and therapeutic potential. Signal Transduct Target Ther. 2020 Oct 7;5(1):227.
11. Kimura N et al. Comparison of metabolic fates of nicotinamide, NAD+ and NADH administered orally and intraperitoneally; characterization of oral NADH. J Nutr Sci Vitaminol (Tokyo). 2006 Apr;52(2):142-8.
12. Wang P et al. Perivascular adipose tissue-derived visfatin is a vascular smooth muscle cell growth factor: role of nicotinamide mononucleotide. Cardiovasc Res. 2009 Feb 1;81(2):370-80.
13. Yao Z et al. Nicotinamide mononucleotide inhibits JNK activation to reverse Alzheimer disease. Neurosci Lett. 2017 Apr 24:647:133-140.
14. Okabe K et al. Implications of altered NAD metabolism in metabolic disorders. J Biomed Sci. 2019; 26: 34.
15. Amjad S et al. Role of NAD+ in regulating cellular and metabolic signaling pathways. Mol Metab. 2021 Jul; 49: 101195.
16. Available at. https://www.eurekalert.org/news-releases/466776
17. Imai S-I., Guarente L. It takes two to tango: NAD+ and sirtuins in aging/longevity control. NPJ Aging Mech Dis. 2016 Aug 18:2:16017.
18. Pirinen E et al. Pharmacological Inhibition of Poly(ADP-Ribose) Polymerases Improves Fitness and Mitochondrial Function in Skeletal Muscle. Cell Metab. 2014 Jun 3; 19(6): 1034–1041.
19. Canto C et al. The NAD+ precursor nicotinamide riboside enhances oxidative metabolism and protects against high-fat diet induced obesity. Cell Metab. 2012 Jun 6; 15(6): 838–847.
20. Available at. https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death
21. Zhang H et al. NAD⁺ repletion improves mitochondrial and stem cell function and enhances life span in mice. Science. 2016 Jun 17;352(6292):1436-43.
22. Yoshino J et al. Nicotinamide mononucleotide, a key NAD(+) intermediate, treats the pathophysiology of diet- and age-induced diabetes in mice. Cell Metab. 2011 Oct 5;14(4):528-36.
23. Rotllan N et al. Therapeutic Potential of Emerging NAD+-Increasing Strategies for Cardiovascular Diseases. Antioxidants (Basel). 2021 Dec; 10(12): 1939.
24. Borradaile NM et al. NAD(+), sirtuins, and cardiovascular disease. Curr Pharm Des. 2009;15(1):110-7.
25. Available at. https://www.who.int/news-room/fact-sheets/detail/ageing-and-health
26. Xing S et al. Nicotinamide phosphoribosyltransferase-related signaling pathway in early Alzheimer's disease mouse models. Mol Med Rep. 2019 Dec; 20(6): 5163–5171.
27. Lautrup S et al. NAD+ in Brain Aging and Neurodegenerative Disorders. Cell Metab. 2019 Oct 1;30(4):630-655.
28. de Guia RM et al. Aerobic and resistance exercise training reverses age‐dependent decline in NAD+ salvage capacity in human skeletal muscle. Physiol Rep. 2019 Jun; 7(12): e14139.
29. Grozio A et al. Slc12a8 is a nicotinamide mononucleotide transporter. Nat Metab. 2019 Jan; 1(1): 47–57.